Е.С. Невирович, А.Г. Борискин
НИИ хирургии и неотложной медицины ПСПбГМУ им. акад. И.П. Павлова
Лапароскопическую радикальную простатэктомию (ЛПРЭ) с 1991 года применяют как альтернативу открытым органоуносящим оперативным вмешательствам. После разработки в 2000 году роботизированной радикальной простатэктомии (РРПЭ) этот метод стали использовать в качестве стандартного лечения локализованного рака предстательной железы (РПЖ) [1,2]. Несмотря на достижения в области онкологического контроля и выживаемости, недержание мочи попрежнему остается одним из наиболее значимых и определяющих качество жизни симптомом у пациентов, перенесших радикальную простатэктомию [3]. Основываясь на оценке осложнений и текущем знании хирургической анатомии, одна из задач оперативного пособия – сохранение эндопельвикальной фасции, сухожильного центра промежности, сплетения Санторини и сосудисто-нервных пучков, что положительно влияет на более раннее и полное удержание мочи в послеоперационном периоде [4,5].
Возвращаясь к истории открытой хирургии необходимо отметить, что промежностная радикальная простатэктомия впервые описана Hugh Young в 1905 году. К преимуществам метода по сравнению с радикальной позадилонной простатэктомией, описанной Mitlin в 1947 году, традицион-но относят лучшее сохранение тазовой анатомии и отсутствие необходимости «входить» в брюшную полость. Одним из недостатков является то, что диссекция тазовых лимфатических узлов не может быть выполнена из промежностного доступа. Частичное решение проблемы в эру минимально-инвазивной хирургии – лапароскопическая лимфодиссекция.
Следует отметить, что любые лапароскопические, роботизированные, трансперитонеальные или предперитонеальные доступы к предстательной железе (ПЖ) предусматривают вскрытие ретциевого пространства и выделениемочевого пузыря спереди и по боковым поверхностям.
Несмотря на то, что позадилонная простатэктомия – самый изученный и проверенный метод в нашей повседневной практике, анализ послеоперацинных осложнений указывает на проблемы с удержанием мочи у трети пациентов в течение первого года после выполненной операции [6]. И хотя через 12 месяцев 97,4% больных не используют урологические прокладки, в первые недели после удаления уретрального катетера частота недержания мочи крайне высока [7].
В 2010 году А. Galfano впервые описал новую технику сохранения всех анатомических структур, связанных с удержанием мочи – ретциуссберегающую (РС) простатэктомию. Доступ к ПЖ осуществляется непосредственно через пространство Дугласа, без диссекции предпузырного пространства [8]. После открытия париетальной брюшины в пузырно-прямокишечном углублении ПЖ удаляли в полностью внутрифасциальном пространстве без повреждения сплетения Санторини, лоно-простатических связок, сухожильного центра промежности и мышцы леватора. Эта же хирургическая группа продемонстрировала превосходные результаты у первых 200 пациентов – 90-92% больных сразу после операции удерживали мочу и 96% удерживали мочу через год после лечения [9]. Ретциус-сберегающую лапараскопическую радикальную простатэктомию (РС-ЛРПЭ) применяют в нашей клинической практике при выполнении ЛРПЭ.
Цель настоящего исследования – сравнение результатов стандартной ЛРПЭ c РС-ЛРПЭ и оценка связи восстановления удержания мочи с опущением шейки мочевого пузыря, основанная на данных послеоперационной цистографии.
МАТЕРИАЛЫ И МЕТОДЫ
С марта 2017 по апрель 2018 года в отделении онкоурологии НИИ хирургии и неотложной медицины ПСПбГМУимакад. И.П. Павлова прооперировано 59 пациентов с морфологически верифицированным РПЖ локализованной формы в возрасте 65,7±10,3 лет. Всем пациентам выполнено оперативное лечение РПЖ, из них 28 (47%) пациентам выполнена РС-ЛРПЭ, 31 (53%) пациент оперирован по стандартной методике ЛРПЭ одним хирургом. При этом достоверных отличий по возрасту, основным клинико-лабораторным и инструментальным показателям между группами пациентов с различными методами оперативного пособия не было (табл. 1). Среди пациентов, прооперированныхЛРПЭ, у одного (3,2 %) пациента стадия РПЖ соответствовалаТ1b, у 11 (35,5%) –Т1с, у 15 (48,4) – Т2а, у 4 (12,9%) – Т2b. Среди пациентов, прооперированных РС-ЛРПЭ, у одного пациента (3,6%) стадия РПЖ соответствовала Т1b, у 12 (42,9%) – Т1с, у 12 (42,9%) – Т2а, у 3 (10,7%) – Т2b. Индекс здоровья простаты [10,11], косвенно указывающий на вероятность наличия клинически значимой аденокарциномы для всех включенных в исследование пациентов, составил в среднем 49,8±17,6 и также демонстрировал статистически не значимую разницу в обеих группах. Таким образом количество пациентов со схожими стадиями РПЖ достоверно не отличалось в зависимости от метода оперативного пособия.
Методика РС-ЛРПЭ. В положении Тренделенбурга больного на операционном столе устанавливают эндопорты, используют лапароскоп 0o. В ректовезикальном углублении производят небольшой разрез париетальной брюшины со стороны мочевого пузыря. Мобилизуют дистальные части семявыносящих протоков и семенные пузырьки. Приподнимая вверх выделенные семенные пузырьки, выделяют пространство между фасцией Деннонвилье и задней поверхностью ПЖ. Диссекцию продолжают до уровня верхушки ПЖ, тем самым сохраняя сосудисто-нервные пучки. При необходимости более широкого выделения, фасцию Деннонвилье оставляют на стороне ПЖ для достижения максимального иссечения близлежащих структур. Используя тягу за семенные пузырьки латерально, производят выделение боковых поверхностей ПЖ, после чего сосудистые ножки ПЖ лигируют и производят интрафасциальное либо экстрафасциальное выделение ткани ПЖ в зависимости от стадии заболевания. Далее диссекцию продолжают до уровня верхушки ПЖ и дорсального венозного комплекса. Используя тягу за семенные пузырьки вниз и приподнимая заднюю стенку мочевого пузыря вверх, открывают область шейки мочевого пузыря, которую выделяют до уровня внутреннего отверстия, проводят круговую диссекцию и пересекают (отсекается от ПЖ). Выделение верхушки ПЖ проводят без предварительного лигирования дорсального венозного комплекса, выделяют максимально возможную часть уретры со сфинктером и пересекают. Пузырно-уретральный анастомоз накладывают нитью V-Loc 3/0 c иглой 5/8 непрерывным швом. Дефект париетальной брюшины ушивают. Цистограмму выполняют на 6-7 сутки после операции. Если не определяют подтекание контрастного вещества за пределы анастомоза, катетер Фолея удаляют.
При анализе цистограмм проводили измерение расстояния от шейки мочевого пузыря до верхнего края симфиза и общей высоты лонного симфиза. Соотношение этих значений – коэффициент смещения шейки (КСШ) – доказало свою ценность при прогнозировании удержания мочи после операции [12].
При оценке цистограмм оказалось, что в группе РС-ЛРПЭ КСШ достоверно меньше значений в группе сравнения (0,21±0,09 vs 0,45±0,2). Этот результат подразумевает, что смещение шейки мочевого пузыря относительно верхнего края лобкового симфиза меньше при выполнении РС-ЛПРЭ.
Отмечено, что сразу после удаления уретрального катетера после РС-ЛРПЭ удержание мочи зафиксировано у 14 из 28 больных, тогда как в группе после стандартной ЛРПЭ лишь у 3-х пациентов (9,6%).
Обследование пациентов проводили каждые 3 месяца в течение года. Оценку наличия и степени выраженности недержания мочи производили путем анализа заполняемых пациентами опросников МЭБ 13.1 [13]. Количество пациентов, удерживающих мочу, на каждом этапе наблюдения представлено на рисунке 1.
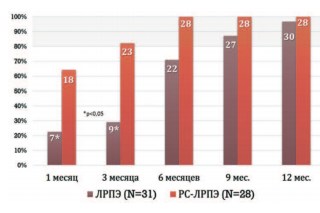
* - статистически значимое различие (p<0,05)
Рис.1. Динамика удержания мочи у наблюдаемых пациентов
Отмечено достоверно значимое различие по времени, необходимом для достижения удержания мочи. В группе РС-ЛПРЭ это наблюдали в среднем по истечении 3,3± 0,73 месяца против 10,6±2,67 месяцев у пациентов группы сравнения. Статистически достоверной разницы между двумя группами пациентов при оценке удержания мочи через год (100% против 96,7%) не выявлено ( табл. 1).
Таблица 1. Сравнительная характеристика и результаты лечения пациентов
| Параметр | ЛРПЭ (N=31) | РС-ЛРПЭ (N=28) | р |
| Возраст, лет | 67,5 ± 6,8 | 64,3 ± 6,2 | 0,154 |
| Индекс массы тела | 29,7 ± 3,4 | 27,1 ± 4,9 | 0,091 |
| Объем предстательной железы, см3 | 46,3 ± 22,7 | 39,2 ± 9,7 | 0,632 |
| Стадия: T1b T1c T2a T2b |
1 (3,2%) 11 (35,5%) 15 (48,4%) 4 (12,9%) |
1 (3,6%) 12 (42,9%) 12 (42,9%) 3 (10,7%) |
0,767 0,355 0,210 0,176 |
| ПСА общий, нг/мл | 6,8 ± 2,7 | 7,2 ±1,9 | 0,348 |
| Индекс Здоровья Простаты | 53,2 ±12,4 | 46,3 ±19,7 | 0,387 |
| Длительность операции, мин | 176,7 ± 47,6 | 161,5 ± 34,4 | 0,158 |
| Кровопотеря, мл | 133,9 ± 59,7 | 124,5 ± 44,1 | 0,347 |
| Коэффициент смещения шейки | 0,45 ± 0,2 | 0,21 ± 0,09 | 0,008* |
| Раннее удержание мочи | 3 (9,6%) | 14 (50,0%) | 0,010* |
| Время до восстановления удержания, мес | 10,6 ± 2,7 | 3,3 ± 0,7 | 0,006* |
| Удержание после 1 года | 30 (96,7%) | 28 (100%) | 0,072 |
* - статистически значимое различие (p<0,05)
Следует отметить, что для достижения подобных результатов части пациентов (29,1%) после ЛРПЭ потребовалось выполнение промежностной и внутриуретральной электромиостимуляции на аппарате «Интратон-3» [14].
Для сравнительного анализа эффективности лечения и оценки частоты послеоперационного недержания мочи мы ретроспективно проанализировали результаты лечения пациентов с локализованной формой РПЖ, которым была проведена стандартная ЛРПЭ. Сопоставив эти данные с пациентами, прооперированными по методике РС-ЛРПЭ, отметили, что способ проведения радикальной простатэктомии с сохранением Cavum Retzii имеет преимущества над стандартной методикой, что подтверждают данные КСШ, рассчитанного на основании проведенных послеоперационных цистограмм. По нашему мнению, данная методика позволяет сочетать преимущества промежностной РПЭ, при которой сохраняется интактным ретциево пространство, и стандартной ЛРПЭ с сохранением эндопельвикальной фасции и мышц тазового дна. С 2017 года этот метод применяют в нашей клинике.
ОБСУЖДЕНИЕ
Соотношение КСШ в цистограмме применяют для определения местоположения шейки мочевого пузыря и прогнозирования послеоперационного удержания мочи. G. Olgin описал метод измерения КСШ в качестве предиктора послеоперационного удержания и сообщил о достоверных различиях вероятности полного удержания мочи при низких (в среднем 0,16), промежуточных (средний 0,41) и высоких значениях КСШ (средняя 0,70) – 80,3%, 72,7% и 59,7%, соответственно [15]. Наши результаты также подтверждают предсказательное значение цистограммы, что может быть использовано как инструмент для прогнозирования функционального исхода или оценки анатомического состояния тазового дна. Кроме того, значения КСШ после РС-ЛРПЭ значительно ниже, чем после ЛРПЭ в нашей хирургической группе. Это может быть связано с меньшим повреждением мышцы, поднимающей задний проход, пубопростатических и пубовезикальных связок, препятствующих опущению мочевого пузыря и способствующих уменьшению гипермобильности мочевого пузыря и раннему удержанию мочи у больных, перенесших оперативное лечение РПЖ [16].
В группе пациентов РС-ЛРПЭ значения объема ПЖ не превышали 50 см3. В идеальных условиях размер ПЖ не должен влиять на выбор метода оперативного пособия. Однако при увеличенной средней доле ПЖ, вдающейся в просвет мочевого пузыря, выделение шейки пузыря и внутреннего отверстия уретры имеет свои особенности. Это связано с тем, что риск повреждения или вовлечения в пузырно-уретральный анастомоз устьев мочеточников, расположенных практически непосредственно на увеличенной средней доле, выше по сравнению со случаями без увеличения ПЖ. По мнению S.K. Lim и соавт., большой размер ПЖ может влиять как на чистоту хирургического края, так и вероятность послеоперационного удержания мочи [17]. Другие авторы не отмечают четкой связи размера ПЖ и длительности операции, не подтверждая повышенные хирургические сложности [18, 19].
У пациентов также прослежено влияние возраста на вероятность удержания мочи в послеоперационном периоде [20, 21]. У пациентов более пожилого возраста отмечено меньшее достижение удержания мочи (CR=0,85, 95%), что связано с ухудшением функции мышцы сфинктера [22].
Несмотря на ограниченный опыт, мы получили результаты, на основании которых можно говорить о том, что РС-ЛРПЭ возможно применять с превосходными функциональными результатами без ущерба для онкологического контроля, и данный метод может быть принят в будущем для более широкого практического применения.
ВЫВОДЫ
Радикальная простатэктомия с сохранением ретциевого пространства – эффективный метод, позволяющий проводить радикальное хирургическое лечение РПЖ с максимальным сохранением окружающих структур и тканей, а также минимальной послеоперационной дислокацией шейки мочевого пузыря в малый таз.
ЛИТЕРАТУРА
- SchuesslerWW, Schulam PG,ClaymanRV,Kavoussi LR. Laparoscopic radical prostatectomy: initial short-term experience. Urology 1997:Dec;50(6):854-857. doi: 10.1016/S0090-4295(97)00543-8.
- Menon M, Shrivastava A, Tewari A, Sarle R, Hemal A, Peabody JO et al. Laparoscopic and robot assisted radical prostatectomy: establishment of a structured program and preliminary analysis of outcomes. J Urol 2002;Sep;168(3):945-949. doi: 10.1097/01.ju.0000023660.10494.7d.
- Arcila-Ruiz M, Brucker BM.e Role of Urodynamicsin Post-Prostatectomy Incontinence. Curr Urol Rep 2018;Feb26;19(3):21. doi: 10.1007/s11934-018-0770-7.
- Walz J, Burnett AL, Costello AJ, Eastham JA, Graefen M, Guillonneau B et al. A critical analysis of the current knowledge of surgical anatomy related to optimization of cancer control and preservation of continence and erection in candidates for radical prostatectomy. Eur Urol 2010;57(2):179-192. doi: 10.1016/j.eururo.2009.11.009.
- Lepor H. A review of surgical techniques for radical prostatectomy. Rev Urol 2005;7 (Suppl 2):S11-17. PMCID: PMC1477597. PMID: 16985892.
- Аль-Шукри С.Х., Невирович Е.С., Аль-Шукри А.С., Борискин А.Г., Тюрина Ю.В. Опыт применения лапаролифта при лапароскопической радикальной простатэктомии Урологические ведомости 2015;1(5):52.
- Ou YC, Yang CK, Kang HM, Chang KS, Wang J, Hung SW at al. Pentafecta outcomes of 230 cases of robotic-assisted radical prostatectomy with bilateral neurovascular bundle preservation. Anticancer Res 2015;35(9):5007-5013. PMID: 26254400.
- Galfano A, Ascione A, Grimaldi S, Petralia G, Strada E, Bocciardi AM. A new anatomic approach for robot-assisted laparoscopic prostatectomy: a feasibility study for completely intrafascial surgery. Eur Urol 2010;Sep;58(3):457-461. doi: 10.1016/j.eururo.2010.06.008.
- Galfano A, Di Trapani D, Sozzi F, Strada E, Petralia G, Bramerio M еt al. Beyond the learning curve of the Retzius-sparing approach for robot-assisted laparoscopic radical prostatectomy: oncologic and functional results of the first 200 patients with ≥ 1 year of follow-up. Eur Urol 2013;64(6):974-980. doi: 10.1016/j.eururo.2013.06.046.
- Рыбалов М.А., Аль-Шукри С.Х., Боровец С.Ю. Современные иммуногистохимические маркеры в ранней диагностике рака предстательной железы (обзор литературы). Урологические ведомости 2012;2(2):38-40.
- Понкратов С.В., Хейфец В.Х., Каган О.Ф. Диагностическая ценность простатспецифического антигена с учетом возраста пациентов. Урологические ведомости 2016;3(6):30-39. doi:10.17816/uroved6330-39.
- Ha YS, Bak DJ, Chung JW, Lee JN, Kwon SY, Choi SH, et al. Postoperative cystographic findings as an independent predictor of urinary incontinence three months after radical prostatectomy. Minerva Urol Nefrol 2017;69(3):278-284. doi: 10.23736/S0393-2249.16.02763-6
- Аль-Шукри С.Х., Невирович Е.С., Аль-Шукри А.С., Борискин А.Г., Тюрина Ю.В. Оценка качества жизни больных после радикальной простатэктомии с использованием анкеты МЭБ 13.1. Урологические ведомости 2013;3(3):3-9
- Аль-Шукри С.Х., Ананий И.А., Амдий Р.Э., Кузьмин И.В. Электростимуляция мышц тазового дна в лечении больных с недержанием мочи после радикальной простатэктомии. Урологические ведомости 2016;4(6):10-13. doi: 10.17816/uroved6410-13.
- Olgin G, Alsyouf M, Han D, Li R, Lightfoot M, Smith D at al. Postoperative cystogram findings predict incontinence following robot-assisted radical prostatectomy. J Endourol 2014;28(12):1460-1463. doi: 10.1089/end.2014.0236.
- Hung SC, Ou YC, Cheng CL еt al: Standardized procedure of robotic assisted laparoscopic radical prostatectomy from case 1 to case 1200. Urol Sci 27(4): 199-207, 2016.
- Lim SK, Kim KH, Shin TY, Han WK, Chung BH, Hong SJ at al: Retzius-sparing robotassisted laparoscopic radical prostatectomy: combining the best of retropubic and perineal approaches. BJU Int 2014;114(2):236-244. doi: 10.1111/bju.12705.
- Hu JC, Chiu KY. Laparoscopic Retzius-Sparing radical prostatectomy: Single surgeon experiences. J Endourol Videourology 2017;31. https://doi.org/10.1089/vid.2016.0044.
- Dev HS, Sooriakumaran P, Srivastava A, Tewari AK. Optimizing radical prostatectomy for the early recovery of urinary continence. Nat Rev Urol 2012;24;9(4):189-195. doi: 10.1038/nrurol.2012.2.
- Santok GD, Abdel Raheem A, Kim LH, Chang K, Lum TG, Chung BH et al. Perioperative and short-term outcomes of Retzius-sparing robot-assisted laparoscopic radical prostatectomy stratified by gland size. BJU Int 2017;119(1):135-141. doi: 10.1111/bju.13632.
- Sacco E, Prayer-Galetti T, Pinto F, Fracalanza S, Betto G, Pagano F, еt al. Urinary incontinence after radical prostatectomy: incidence by definition, risk factors and temporal trend in a large series with a long-term follow-up. BJU Int 2006;97(6):1234-1241. doi:10.1111/j.1464-410X.2006.06185.x.
- Wolin KY, Luly J, Sutcliffe S, Andriole GL, Kibel AS. Risk of urinary incontinence following prostatectomy: the role of physical activity and obesity. J Urol 2010;183(2):629-633. doi: 10.1016/j.juro.2009.09.082.
Статья опубликована в журнале"Экспериментальная и клиническая урология" №4 2018, стр. 36-39








Комментарии