Гасанов Н.Г., Гамидов С.И., Шатылко Т.В., Попова А.Ю., Лоран О.Б., Макарова Н.П., Ушакова И.В.
Сведения об авторах:
- Гасанов Н.Г. – врач-уролог ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава РФ, natiqhasan@gmail.com
- Гамидов С.И. – д.м.н., профессор, руководитель отделения андрологии и урологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава РФ, профессор кафедры аку- шерства, гинекологии и перинатологии ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» Минздрава РФ (Сеченовский Университет), safargamidov@yandex.ru
- Шатылко Т.В. – ФГБУ «Национальный медицинский исследовательский центр аку- шерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава РФ dialectic.law@gmail.com
- Попова А.Ю. – ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава РФ, доцент кафедры акушерства, гинекологии и перинатологии ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» Минздрава РФ (Сеченовский Университет), alina-dock@ya.ru
- Лоран О.Б. – д.м.н., профессор, академик РАН, заведующий кафедрой урологии и хирургической андрологии непрерывного профессионального образования» Российской Федерации, olegloran@gmail.com
- Макарова Н.П. – к.б.н., эмбриолог ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Министерства здравоохранения Российской Федерации
- Ушакова И.В. – к.б.н., эмбриолог исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава РФ
Хирургические методы получения сперматозоидов применяются в сочетании с интрацитоплазматической инъекцией сперматозоида в ооцит (ICSI) с целью реализации репродуктивных планов у бесплодных пар с азооспермией [1]. Известно, что частота получения сперматозоидов (ЧПС) при обструктивной азооспермии (ОА) практически равна 100%, тогда как при необструктивной азооспермии (НОА) на фоне тяжелых нарушений сперматогенеза ЧПС в значительной степени зависит от метода биопсии яичка, особенностей популяции и селекции пациентов, а также от того, что тот или иной автор подразумевает под «успешным» получением сперматозоидов [2].
Однако, успех биопсии яичка еще не гарантирует паре положительного репродуктивного результата. Рождение ребенка возможно только в результате успешного взаимодействия гамет после ICSI, переноса эмбриона, благоприятного развития плода и нормального течения беременности на всех этапах. В связи с этим, получение сперматозоидов при азооспермии следует считать лишь суррогатной конечной точкой, по которой можно сравнивать между собой различные хирургические методики, но не делать выводы об их клинической эффективности. Истинной конечной точкой в работах по хирургическим методам получения сперматозоидов является частота рождения детей (ЧРД).
Как правило, при ОА всегда удается добиться получения сперматозоидов нормального качества в достаточном количестве для криоконсервации или немедленной ICSI. При НОА наблюдается иная ситуация: даже в случае успешной биопсии сперматозоидов обычно мало, а качество их далеко от оптимального, особенно при тяжелых формах нарушения сперматогенеза [3]. Исход ICSI и последующего переноса эмбриона зависит от сочетания гинекологических и андрологических факторов, а течение беременности начиная со второго триместра определяется уже преимущественно здоровьем женщины. Тем не менее, нередко репродуктологи и эмбриологи убеждают пары с НОА не прибегать к хирургическим методам экстракции сперматозоидов, а сразу воспользоваться донорским материалом, исходя из предпосылки о недостаточном качестве собственных половых клеток у таких мужчин. В связи с этим мы провели исследование, целью которого было определить ЧРД в парах с азооспермией и установить влияющие на ЧРД факторы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Мы провели ретроспективный анализ базы данных, в которую вошла информация по 754 пациентам с азооспермией, которым было выполнено в общей сложности 813 попыток хирургического получения сперматозоидов. У пациентов с ОА применялась микрохирургическая аспирация сперматозоидов из придатка яичка (MESA), реже – пункционные методы получения сперматозоидов (PESA / TESA). При НОА проводилась микродиссекционная биопсия яичка (microTESE). Сперматозоиды были успешно получены в 289 случаях. У 256 пациентов полученный биологический материал был использован для ICSI, а у остальных был криоконсервирован, но не использован на момент написания данной статьи. Информация по этим 256 пациентам была использована для дальнейшего анализа ЧРД. Из них 162 пациента (63,3%) имели НОА по данным гистологического исследования образца тестикулярной паренхимы, а 90 пациентов (35,1%) имели ОА. Четырем пациентам (1,6%) биопсия яичка выполнялась в связи с грубой эякуляторной дисфункцией и неэффективностью стандартных методов получения биологического материала.
Были подсчитаны частота наступления беременности (ЧНБ), общая частота рождения детей (среди всех попыток биопсии яичка, ОЧРД) и специфическая частота рождения детей (только среди успешных попыток биопсии яичка с последующей ICSI, СЧРД). Под наступлением беременности понимали биохимический ответ с повышением уровня бета-субъединицы хорионического гонадотропина в крови после переноса эмбриона. Под рождением ребенка подразумевали роды через естественные родовые пути или оперативное родоразрешение независимо от срока гестации, за исключением случаев мертворождения. Многоплодных беременностей в нашей выборке не было, что объясняется тактикой переноса одного эмбриона. Показатели ЧРД при ОА и НОА были сопоставлены между собой, причем ОА в данном сравнении условно служила в качестве референсного стандарта, т.к. ОА по определению характеризуется наличием нормального сперматогенеза. ЧРД сравнивалась с использованием метода хи-квадрат Пирсона. Учитывая поправку Бонферрони для пяти сравнений (ЧПС, общая ЧНБ, специфическая ЧНБ, ОЧРД, СЧРД) различия считались статистически значимыми при p < 0,003125.
Была построена модель логистической регрессии для анализа факторов, способных повлиять на СЧРД в парах, где у мужчины были успешно получены сперматозоиды при азооспермии. В качестве зависимой в нее включена бинарная переменная, характеризующая финальный репродуктивный результат (0 – отсутствие ребенка в паре; 1 – произошло рождение живого ребенка). В модель вошли следующие независимые переменные: возраст пациента, возраст жены, номер попытки биопсии, длительность вынужденного бесплодия, наличие гинекологической патологии, уровень половых гормонов (тестостерон, эстрадиол, лютеинизирующий гормон – ЛГ, фолликулостимулирующий гормон – ФСГ, пролактин, прогестерон, ингибин B), суммарный объем яичек по данным ультразвукового исследования органов мошонки, наличие синдрома Кляйнфельтера, наличие хромосомных аномалий, наличие делеций в регионе AZFc Y-хромосомы, наличие мутаций гена муковисцидоза (CFTR), наличие варикоцеле (одностороннего или двустороннего), наличие химиотерапии или лучевой терапии в анамнезе, наличие сахарного диабета, злоупотребление алкоголем, табакокурение, регулярное нарушение теплового режима (горячие ванны, посещение бани или сауны, работа в горячих цехах или на кухне), перенесенные оперативные вмешательства в пахово-мошоночной области (варикоцелэктомия, гидроцелэктомия, грыжесечение, орхипексия). Влияние каждого фактора оценивалось по отношению вероятностей (ОВ) рождения живого ребенка с 95%-ным доверительным интервалом (95% ДИ). Фактор считался независимым значимым предиктором при p < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
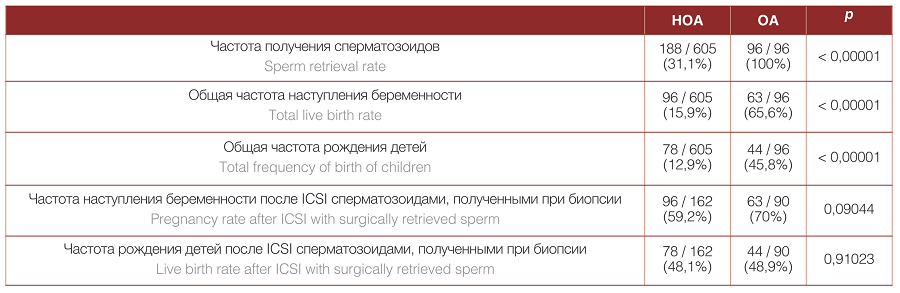
После окончательного определения вида азооспермии с учетом результатов гистологического исследования ЧПС при НОА составила 31,1% (188 из 605 попыток), ЧПС при ОА составила 100% (96 из 96 попыток). ОЧРД в общей популяции составила 17,5% в пересчете на каждую процедуру биопсии яичка; ОЧРД в пересчете на одну пару была равна 18,9%. В парах, где у мужчины была ОА, ОЧРД составила 45,8%, что примерно соответствует частоте успеха стандартной попытки экстракорпорального оплодотворения. При НОА этот показатель составил лишь 12,9%.
Учитывая заведомо низкую ЧПС у пациентов с НОА, в финальный анализ для определения СЧРД вошли данные 256 пациентов, у которых сперматозоиды были успешно получены, а затем использованы для ICSI. При условии того, что сперматозоиды имели приемлемое качество и были обнаружены достаточном количестве, СЧРД составила 48,1% и 48,9% при НОА и ОА соответственно; разница не достигла порога статистической значимости (p = 0,91023). При эякуляторной дисфункции добиться рождения ребенка после ICSI с использованием полученных хирургическим путем сперматозоидов удалось в 2 из 4 пар. Результаты сравнения ЧРД в категориях пациентов с ОА и НОА представлены в таблице 1. Интересным представляется факт, что при сравнении частоты наступления беременности (ЧНБ) отмечалась тенденция к более высокому значению этого показателя при ОА, хотя она не имела статистической значимости и не отразилась на СЧРД.
Таблица 1. Сравнение частоты рождения детей в парах с обструктивной и необструктивной азооспермией
Table 1. Comparison of live birth rate in couples with obstructive and non-obstructive azoospermia
Проведен анализ логистической регрессии для выявления предикторов рождения ребенка в парах с азооспермией. Результаты анализа показаны в таблице 2.
Таблица 2. Предикторы рождения детей в парах после ICSI с использованием сперматозоидов, полученных хирургическим путем
Table 2. Predictors of live birth in couples undergoing ICSI with surgically retrieved sperm
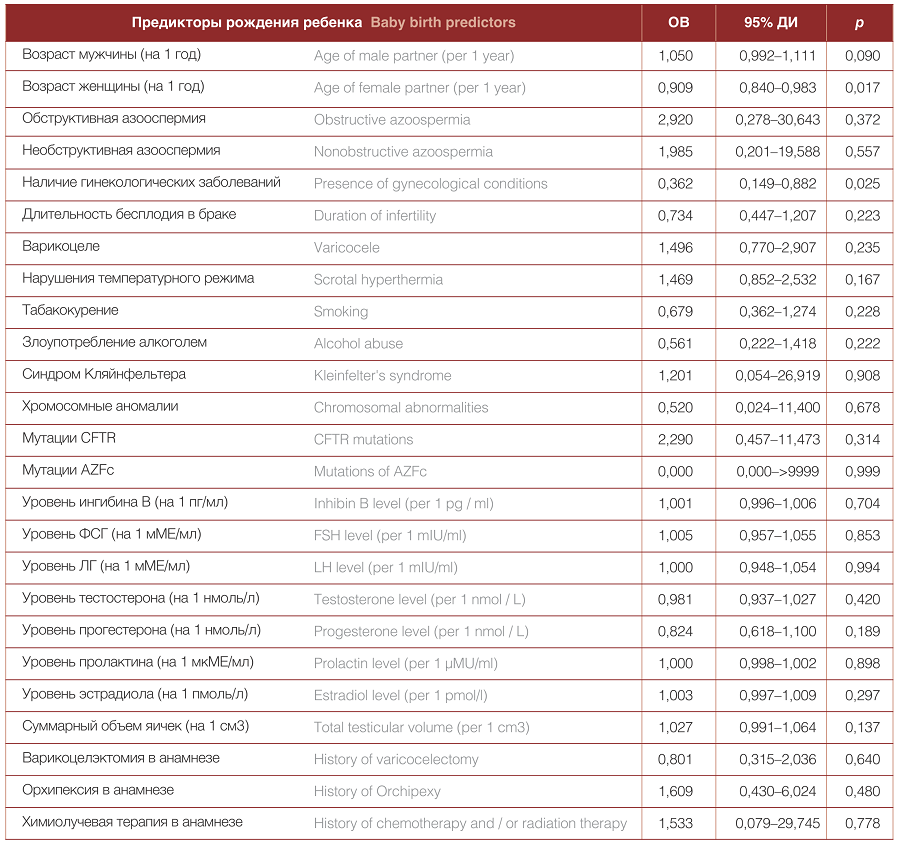
В парах с азооспермией, где у мужчины удалось получить сперматозоиды хирургическим путем, единственными значимыми факторами, негативно влияющими на вероятность рождения ребенка, оказались возраст женщины (ОВ = 0,909 на 1 год; 95% ДИ = 0,840–0,983; p = 0,017) и наличие гинекологических заболеваний, способных повлиять на результаты овариальной стимуляции, имплантацию эмбриона и процесс течения беременности (ОВ = 0,362; 95% ДИ = 0,149– 0,882; p = 0,025). В частности, в парах, включенных в анализ, встречались синдром поликистозных яичников, снижение овариального резерва, миома матки, эндометриоз и хронический эндометрит. При этом ни один из андрологических факторов, включая вид и этиологию азооспермии, не сказывался на вероятности рождения ребенка после ICSI. Любопытно, что генетические факторы и аномалии кариотипа у мужчины также не оказывали влияния на СЧРД.
Значимых положительных предикторов рождения ребенка при азооспермии выявить не удалось.
Заслуживают внимания отдельные случаи рождения детей у пациентов с относительно редкими причинами бесплодия. В анализ вошли два пациента с врожденной атрезией vas deferens и мутациями гена CFTR. Процедура MESA оказалась эффективной в обоих случаях. У супруги одного из пациентов родился здоровый ребенок в результате ICSI с преимплантационной генетической диагностикой. Во второй паре первая попытка ICSI оказалась неудачной, но криоконсервированный материал может быть использован для повторных попыток в будущем. Также в выборке было 2 мужчин, которым выполнялась биопсия яичка после радикальной простатэктомии (возраст: 41 и 82 года). У них удалось с первой попытки получить сперматозоиды при PESA / TESA, в результате чего после ICSI произошло рождение здоровых детей. У пациента после радикальной цистпростатвезикулэктомии, выполненной по поводу уротелиального рака мочевого пузыря (возраст: 27 лет), удалось получить сперматозоиды с помощью пункционной методики, однако единственная на данный момент попытка ICSI у его супруги оказалась неудачной.
ОБСУЖДЕНИЕ
Наше исследование является одним из немногих, где представлены полноценные репродуктивные исходы пар с азооспермией. Это связано с трудностями, возникающими при наблюдении за данной категорией пациентов: вскоре после успешного получения сперматозоидов пара полностью переходит под контроль гинеколога-репродуктолога и эмбриолога, тогда как уролог-андролог фактически теряет доступ к информации о дальнейшей судьбе пациента и его супруги. Благодаря технологии криоконсервации, процедура биопсии яичка и попытка ICSI могут быть существенно разобщены во времени, а благодаря возможности транспортировки биоматериала – разобщены в пространстве. Кроме того, оценить ЧРД можно лишь тогда, когда период наблюдения за каждой парой составляет как минимум 9 месяцев, оптимально – 1 год и более. Благодаря замкнутому циклу оказания репродуктологической помощи и наличию подробной информации в базе данных нашего Центра, мы смогли в той или иной степени преодолеть данные барьеры и провести объективный ретроспективный анализ факторов, влияющих на ЧРД при азооспермии.
Специфическая ЧНБ при ОА оказалась выше, чем ЧНБ при НОА (70% против 59,2%), хотя эта разница и не была статистически значимой. A. Nagano и соавт. сообщали о ЧНБ, равной 79,7%, 61,1% и 56,1% при ОА, НОА и при использовании сперматозоидов из эякулята [4]. Интересно, что наблюдавшаяся в нашем исследовании разница по ЧНБ не отразилась на реальной частоте рождения живых детей, что говорит о том, что анализ по наступлению беременности не всегда корректен.
Общая ЧРД при ОА в нашей выборке составила 45,8%, что является относительно хорошим результатом. В исследовании М. Van Wely и соавт. ЧРД после MESA и TESE при ОА составила 39% и 24% соответственно [5]. Здесь, однако, следует учесть тот факт, что мы ориентировались на кумулятивную ЧРД, а М. Van Wely и соавт. при подсчете этого параметра учитывали только первую попытку ICSI. В исследовании Y. Yu и соавт. показатель ЧРД при ОА составил 38,2% [6].
Многие авторы указывают на то, что ЧРД при НОА невысока, но это может быть связано в первую очередь с низкой ЧПС. Действительно, ОЧРД при НОА составила в нашем исследовании 12,9%. Для сравнения, в работе А.L. Barbotin и соавт. ОЧРД при НОА, ассоциированном с односторонним и двусторонним крипторхизмом, составила 26,4% и 16,1% на фоне ЧПС, равной 66,2% и 60,0% соответственно [7]. ОЧРД при синдроме Кляйнфельтера в работе Vloeberghs и соавт. составила 10,1%, а при анализе только среди пациентов с положительным результатом биопсии СЧРД составила 35,9% [8]. Almekaty et al. сообщают о ЧРД после microTESE, равной 15.5% [9]. К сожалению, не все авторы проводили отдельный подсчет CЧРД при условии успеха биопсии яичка. Этот подсчет имеет ограниченную практическую значимость, так как бесплодную пару на этапе консультирования рациональнее было бы осведомлять о вероятности получить собственное биологическое потомство, а не о различных гипотетических сценариях. Однако, только оперируя подобными данными можно было бы полноценно сопоставить ЧРД при ОА и НОА, устраняя искажающее влияние ЧПС. Кроме того, низкие значения ОЧРД при НОА, встречающиеся в литературе, формируют излишне пессимистичное отношение к репродуктивному потенциалу тестикулярных сперматозоидов при НОА. На наш взгляд, в научных исследованиях целесообразно предоставлять данные по ОЧРД и СЧРД по отдельности. В любом случае, пациент должен быть предупрежден о том, что получение сперматозоидов еще не является гарантией биологического отцовства.
Анализ субпопуляции наших пациентов, у которых сперматозоиды были успешно получены, продемонстрировал отсутствие значимых различий между НОА и ОА в плане вероятности рождения ребенка. Напротив, в исследовании Y. Yu и соавт. сообщается о ЧРД при НОА, равной 24,6%, что было значительно ниже, чем ЧРД при ОА (38,2%) и ЧРД при использовании донорских сперматозоидов (41,3%) [6]. Наши данные согласуются с работой E. Erdem и соавт, где ЧРД при НОА составила 23,7%, а при ОА – 25,6% [10]. Несмотря на то, что эти показатели были меньше, чем полученные нами, в первую очередь здесь важно отсутствие влияния разновидности азооспермии на ЧРД. Действительно, S. Esteves и A. Agarwal в своем систематическом обзоре отмечают низкую ЧРД в группе НОА, но в то же время подчеркивают, что частота невынашивания беременности и эктопической беременности практически не отличается при ОА, НОА и при использовании сперматозоидов из эякулята, что еще раз говорит о том, что разница в ЧРД обусловлена лишь разницей в ЧПС [11].
Что касается столь широкого диапазона представленных в литературе показателей ЧРД, то он объясняется несколькими факторами:
- Отсутствие единого определения ОА и НОА: многие авторы при определении вида азооспермии ориентируются на клинические показатели (уровень половых гормонов, объем яичек и др.), тогда как мы ориентировались на данные гистологического исследования, что является более достоверным; более того, во многих работах вообще не указывается, какие случаи относили к НОА, а какие – к ОА.
- Отсутствие единых критериев успешного хирургического получения сперматозоидов: на практике нередко приходится сталкиваться с пограничными ситуациями, когда в ткани яичка обнаруживают единичные и/или поврежденные сперматозоиды, практически непригодные для ICSI. При этом можно формально утверждать, что сперматозоиды получены, хотя это не приведет к положительному репродуктивному результату, поэтому мы интерпретируем такие попытки биопсии яичка как неудачные. В тех исследованиях, где эти случаи относят к успешным биопсиям, ЧПС оказывается выше, а ЧРД, напротив, ниже. Мы не можем утверждать, какой подход является правильным, но очевидно, что для корректной интерпретации результатов эти нюансы должны отражаться в текстах научных статей, что делается не всегда.
- Возможность криоконсервирования сперматозоидов: кумулятивная ЧРД зависит от того, на протяжении какого времени тот или иной клинический центр работает с пациентами с азооспермией; в длительно функционирующих центрах пары имеют возможность несколько раз за много лет воспользоваться криоконсервированными сперматозоидами, повышая ЧРД в клинике.
A. Meijerink и соавт. разработали предиктивную модель для рождения ребенка в результате ICSI с использованием сперматозоидов, полученных хирургическим путем [12]. Они установили, что вероятность рождения живого ребенка выше при более молодом возрасте женщины, в первом цикле TESE-ICSI, при меньшем уровне ЛГ у мужчины, при более высоком уровне тестостерона у мужчины, при использовании подвижных сперматозоидов, а также при клиническом диагнозе «обструктивная азооспермия». Наши данные согласуются с вышеописанными только в плане влияния женского возраста на вероятность рождения ребенка. Ни гормональные показатели, ни вид азооспермии в нашей работе не влияли на данный результат. К сожалению, мы не имели возможности включить в анализ эмбриологические переменные, такие как характеристика сперматозоида, использованного для ICSI. В работе Meijerink и соавт. произошло 224 родов после 1006 циклов TESE-ISCI (ОЧРД = 22,3%), хотя четких данных по ЧПС в работе не представлено, как и раздельного описания эффективности ICSI при ОА и НОА. Стоит отметить, что в исследовании A. Meijerink и соавт. применялась обычная TESE без микрохирургической техники. В статье K. Almekaty и соавт. сообщается о наличии значимой корреляции ЧРД только с возрастом женщины, что полностью согласуется с нашими данными; в то же время, наличие гинекологических заболеваний авторы не учитывали [9]. B. Zorn и соавт. обнаружили влияние как мужских, так и женских факторов на ЧРД при азооспермии [13]. Мужскими факторами, влияющими на репродуктивные результаты, были уровень ФСГ, индекс Джонсена, криоконсервация сперматозоидов и их подвижность. Однако, все эти показатели влияли только на эмбриологические результаты (фертилизация, формирование бластоцисты), но не на клинические. На клинический репродуктивный результат, т.е. на ЧРД, оказывали влияние только возраст женщины, что согласуется с нашими данными, и образование бластоцисты, которое мы в нашей работе не оценивали.
Основным ограничением нашего исследования является его ретроспективный характер. Возможно, мы недооцениваем реальную кумулятивную ЧРД, т.к. часть биологического материала продолжает храниться в состоянии криоконсервации и еще может быть с успехом использована в будущем; кроме того, мы не стандартизовали количество циклов ICSI. В нашей базе данных не были доступны показатели антимюллерова гормона, и поэтому мы ориентировались на возраст женщин, как косвенный и довольно неточный показатель овариального резерва и способности к деторождению. Наконец, возможно искажение результатов из-за направленного отбора (selection bias): наши эмбриологи криоконсервировали и использовали для ICSI только сперматозоиды достаточного качества и в достаточном количестве, а если им этого не удавалось, то попытка биопсии признавалась неудачной. Это могло привести, с одной стороны, к искусственному занижению ЧПС, а с другой – к завышению ЧРД при НОА, так как эмбриологи уже на первом этапе строго подходили к выбраковке материала и использовали для ICSI лишь сперматозоиды наилучшего возможного качества.
ЗАКЛЮЧЕНИЕ
Полученные нами данные не дают оснований предполагать, что сперматозоиды, полученные хирургическим путем при НОА, обладают заведомо худшим качеством и могут неблагоприятно влиять на вероятность рождения детей. Большинству пациентов с НОА не следует отказывать в попытке microTESE и убеждать в использовании донорских сперматозоидов, мотивируя это «нежизнеспособностью» эмбрионов и низкой ЧРД. При НОА низкая ЧРД является лишь следствием низкой ЧПС, а не свидетельством в пользу того, что сперматозоиды являются «дефектными». Более того, в нашем анализе ни один андрологический фактор не оказывал значимого влияния на вероятность рождения живого ребенка.
ЛИТЕРАТУРА
- Гамидов С.И., Попова А.Ю., Гасанов Н.Г., Овчинников Р.И., Наумов Н.П., Шатылко Т.В. Роль методов хирургического получения сперматозоидов у пациентов с азооспермией в программах вспомогательных репродуктивных технологий (обзор литературы). Андрология и генитальная хирургия 2018;19(3): 27-34. doi: 10.17650/2070-9781-2018-19-3-27-34. [Gamidov S.I., Popova A. Yu., Gasanov N.G., Ovchinnikov R.I., Naumov N.P., Shatylko T.V. The role of surgical sperm retrieval techniques in patients with azoospermia in assisted reproductive technology programs (literature review). Andrologiya i genital'naya khirurgiya = Andrology and Genital Surgery 2018;19(3): 27-34. doi: 10.17650/2070-9781-2018-19-3-27-34
- Касатонова Е.В., Ефремов Е.А., Мельник Я.И., Залетова В.В., Мсхалая Г.Ж. Опыт применения микрохирургической биопсии яичка и его придатка у пациентов с необструктивной азооспермией. Экспериментальная и клиническая урология 2014;(4):38-42. [Kasatonova E.V., Efremov E.A., Melnik Ya.I., Zaletova V.V., Mshalaya G.J The experiences with the microsurgical testis and epididymis biopsy in patients with non-obstructive azoospermia. Eksperimental'naya i klinicheskaya urologiya = Experimental and clinical urology 2014;(4):38-42.
- Кульченко Н.Г. Качественные критерии морфологической оценки сперматогенеза при азооспермии. Трудный пациент 2018;16(7):48-50. [Kulchenko N.G. Qualitative criteria for morphological evaluation of spermatogenesis in azoospermia. Trudnyy patsiyent = Complex patient 2018;16(7):48-50. (In Russian)].
- Nagano A, Mizuta S, Yamaguchi K, Takaya Y, Kitaya K, Takeuchi T, et al. How long does it take to achieve pregnancy with azoospermia undergoing testicular sperm extraction and intracytoplasmic sperm injection (TESE-ICSI)? Fertil Steril 2017;108(3Suppl): e130. doi: https://doi.org/10.1016/j.fertnstert.2017.07.394
- van Wely M, Barbey N, Meissner A, Repping S, Silber SJ. Live birth rates aer MESA or TESE in men with obstructive azoospermia: is there a difference? Hum Reprod 2015;30(4):761-766.
- Yu Y, Xi Q, Pan Y, Jiang Y, Zhang H, Li L, Liu R. Pregnancy and neonatal outcomes in azoospermic men aer intracytoplasmic sperm injection using testicular sperm and donor sperm. Med Sci Monit 2018;24.;6968–6974. doi: 10.12659/MSM.912613
- Barbotin AL, Dauvergne A, Dumont A, Ramdane N, Mitchell V, Rigot JM. Bilateral versus unilateral cryptorchidism in nonobstructive azoospermia: Testicular sperm extraction outcomes. Asian J Androl 2019. doi: 10.4103/aja.aja_2_19
- Vloeberghs V, Verheyen G, Santos-Ribeiro S, Staessen C, Verpoest W, Gies I, et al. Is genetic fatherhood within reach for all azoospermic Klinefelter men? PLoS One 2018;13(7):e0200300. doi: 10.1371/journal.pone.0200300.
- Almekaty K, Abomelha S, Thum Y, Nicopoullos J, Bracewell-Milnes T, Yap T, et al. Reporting on longitudinal live birth rates and cumulative delivery rates are more realistic outcome measures than sperm retrieval rates in couples undergoing mTESE-ICSI. Hum Fertil (Camb) 2019;22(2):139-144. doi: 10.1080/14647273.2018.1472396.
- Erdem E, Karacan M, Çebi Z, Uluğ M, Arvas A, Çamlıbel T. Results of intracytoplasmic sperm injection performed with sperm retrieved by microscopic testicular sperm extraction in azoospermic patients. Turk J Urol 2018;44(6):462-466. doi: 10.5152/tud.2018.85282.
- Esteves SC, Agarwal A. Reproductive outcomes, including neonatal data, following sperm injection in men with obstructive and nonobstructive azoospermia: case series and systematic review. Clinics (Sao Paulo) 2013;68(S1):141-149.
- Meijerink AM, Cissen M, Mochtar MH, Fleischer K, Thoonen I, de Melker AA, et al. Prediction model for live birth in ICSI using testicular extracted sperm. Hum Reprod 2016 Sep;31(9):1942-51. doi: 10.1093/humrep/dew146.
- Zorn B, Virant-Klun I, Drobni S, Sinkovec J, Meden-Vrtovec H. Male and female factors that influence ICSI outcome in azoospermia or aspermia. Rep BioMed Online 2009;18(2):168-176.
Статья опубликована в журнале "Экспериментальная и клиническая урология" №3 2019, стр. 126-132













Комментарии