Солодкий В.А., Павлов А.Ю., Цыбульский А.Д., Гармаш С.В., Ивашин А.К., Исаев Т.К.
В настоящее время выделяют несколько факторов для оценки риска прогрессирования заболевания у больных с локализованными и местнораспространенными формами рака предстательной железы (РПЖ). Существует несколько схожих классификаций, позволяющих оценить прогноз на основе оценки уровня простатспецифического антигена (ПСА), суммы баллов по шкале Глисон (индекс Глисона), а также данных о распространенности процесса [1, 2, 3]. Наибольшую известность в повседневной практике получила классификация NCCN (National Comprehensive Cancer Network), в которой помимо классических трех групп – низкого, промежуточного и высокого риска – выделяют дополнительные группы очень низкого риска и крайне высокого риска прогрессирования [4]. К группе крайне высокого риска прогрессирования относятся пациентысо стадией заболевания T3b-T4N0M0, индексом Глисона основным 5, индексом Глисона 8-10, полученным из более 4 столбиков с биоптатом [4].
В области радиационной онкологии методом выбора для высокой группы риска прогрессирования является сочетание дистанционной лучевой терапии с длительной андроген-депривационной терапией. Рандомизированные исследования показали не только улучшение биохимической безрецидивной выживаемости, но и общей выживаемости при этой комбинации лечения по сравнению только с одним радиотерапевтическим лечением [5, 6] или только андроген-депривационной терапией [7].
В настоящее время в радиотерапии злокачественных новообразований предстательной железы возможность эскалации дозы с целью повышения эффективности проведения специального лечения достигается за счет применения конформного облучения с 3D-планированием, позволяющим подводить к запланированному объему облучаемых тканей суммарную очаговую дозу в пределах 7680 Гр [8]. Именно эскалация дозы при 3D-конформной дистанционной радиотерапии при локализованном и местнораспространенном раке предстательной железы способствует достижению более выраженного контроля над опухолью [9]. При этом брахитерапия, как метод контактной радиотерапии для лечения больных локализованным РПЖ, а так же с целью эскалации дозы в органе-мишени в комбинации с дистанционной радиотерапией (ДРТ) уже давно нашел свое практическое применение во всех экономически развитых странах мира.
Среди современных радиотерапевтических методов, брахитерапию расценивают как эффективный и более безопасный метод доставки необходимой дозы облучения по сравнению с 3D-конформной лучевой терапией [10]. Несмотря на это, в европейских рекомендациях по лечению РПЖ брахитерапия не расценивается как возможный метод лечения при местнораспространенном раке предстательной железы, а входит в рекомендательный список методов лечения только в группе низкого риска прогрессирования [11]. Считается, что технология внутритканевой лучевой терапии не позволяет полноценно подвести тумороцидную дозу на зону семенных пузырьков, вследствие чего риски локальных рецидивов у таких больных выше по сравнению с пациентами, которым была проведена только дистанционная радиотерапия. Согласно рекомендациям американской ассоциации брахитерапевтов, брахитерапия высокой мощности дозы расценивается как возможный способ лечения больных с локализованным РПЖ высокого риска прогрессирования. Сообщается о возможности проведения высокомощностной брахитерапии у некоторых пациентов со стадией заболевания T3b [12]. И только в рекомендациях NCCN в группе крайне высокого риска прогрессирования брахитерапия расценивается как возможный метод лечения пациентов с инвазивным ростом опухоли в семенные пузырьки [4].
По нашему мнению, столь различные данные ведущих организаций можно объяснить небольшим количеством наблюдений, отсутствием длительных результатов в данной группе пациентов, а также возможными техническими трудностями во время подведения необходимой дозы при местнораспространенном раке предстательной железы.
Цель исследования – oценить клинические результаты лечения больных раком предстательной железы с инвазией опухоли в семенные пузырьки, которым было проведено комплексное лечение в объеме брахитерапии высокой мощности дозы микроисточником Ir192 в сочетании с дистанционной радиотерапией и андроген-депривационной терапией.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены больные РПЖ с инвазией опухоли в семенные пузырьки, относящиеся к группе крайне высокого риска прогрессирования (согласно классификации NCCN) без признаков отдаленного метастазирования.
Все пациенты получали комплексное лечение в объеме сочетанной лучевой терапии – на 1-ом этапе высокомощностная брахитерапия микроисточником Ir192 в разовой очаговой дозе (РОД) 10-15 Гр за 1 фракцию, на 2-ом этапе проводилась дистанционная радиотерапия суммарной очаговой дозой (СОД) 46-48 Гр. на зону предстательной железы и зону регионарного лимфооттока.
Критериями отбора больных в исследование явились следующие факторы:
1. Гистологически подтвержденный РПЖ;
2. Инвазия опухоли в семенные пузырьки, подтвержденная данными магнитно-резонансной томографии (МРТ) с контрастированием;
3. Отсутствие отдаленного метастазирования, подтвержденное данными остеосцинтиграфии, МРТ малого таза с контрастированием;
4. Отсутствие выраженной инфравезикальной обструкции по данным ультразвукового исследования, урофлоуметрии и опросниками IPSS;
5. Согласие на проведение лечения в условиях ФГБУ РНЦРР МЗ РФ методом сочетанной лучевой терапии с предварительным разъяснением возможных токсических реакций и ожидаемых результатов предстоящего лечения.
В нашем ретроспективном исследовании были обработаны все случаи РПЖ в период с января 2009 года по декабрь 2013 г., с клинической стадией T3bN0M0, подвергшиеся комплексному лечению в вышеуказанном объеме.
Из 50 пациентов, удовлетворяющим данным запросам, из дальнейшего наблюдения выбыло 11 пациентов, которые не включены в наше исследование.
Характеристики 39 пациентов приведены в таблице 1.
Таблица 1. Характеристика больных РПЖ, вошедших в исследование
| Количество пациентов | 39 | |
| Стадия Т3bN0M0, чел | 39 | |
| Инвазия в 1 семенной пузырек, чел. | 28 | |
| Инвазия в оба семенных пузырька, чел | 11 | |
| Индекс Глисона | 6 | 10 |
| 7 | 9 | |
| 8 | 6 | |
| 9 | 4 | |
| Инициальный ПСА, нг/мл | 28,9 (2,85-228,5) | |
| Объем предстательной железы, см3 | 27,8 (18-48) | |
| Длительность неадъювантной андроген-депривационной терапии, мес | 3,7 (3,1-7,0) | |
| Длительность адъювантной андроген-депривационной терапии, мес. | 6 (3-12) | |
АНДРОГЕНДЕПРИВАЦИОННАЯ ТЕРАПИЯ И РАДИОТЕРАПИЯ
До радикального лечения все пациенты проходили курс андрогендепривационной терапии антиандрогенами и аналогами ЛГРГ в течение не менее трех месяцев (в среднем 3,7 месяца).
На первом этапе радиотерапевтического лечения пациентам проводилась брахитерапия микроисточником Ir192 РОД 10-15 Гр за одну фракцию
Все вмешательства проводились под спиномозговой анестезией на аппарате Microselectron HDR с использованием трансректального ультразвукового датчика 4-9 MHz. Брахитерапия проводилась в виде одной фракции в разовой очаговой дозе (РОД) 10-15 Гр. При этом значение линейно-квадратичной эквивалентной дозы (LQED2) при двух Гр за фракцию составило 32,9 Гр (при РОД 10 Гр) и 70 Гр (при РОД 15 Гр), (α/β=1,5). Процент предписанной дозы на орган – мишень (V100) составлял не менее 90% (в среднем 96,8%). Процент объема органа-мишени, на который приходится 150% предписанной дозы (V150) составлял менее 33% (в среднем 22,9%). Критическая доза на уретру и прямую кишку составили 110% и 70% от предписанной дозы соответственно. Для вычислений биологически эквивалентной дозы использовалась линейно-квадратичная модель.
При проведении дозиметрического планирования сопоставлялись данные МРТ, трансректального ультразвукового исследования (ТРУЗИ), пункционной биопсии предстательной железы. Вычислялись зоны интереса с высокой степенью вероятности опухолевого роста. В целевой объем облучения входили предстательная железа и максимально доступный объем семенных пузырьков.
Надо отметить особую значимость анализа изображений и результатов биопсии с целью определения точного расположения опухоли, а также степени инвазии последней в парапростатическую клетчатку и семенные пузырьки на момент проведения операции, что, в свою очередь, позволяет судить об адекватном дозовом покрытии опухоли.
Имплантации интрастатов в семенные пузырьки и дозиметрическое планирование зоны предстательной железы и семенных пузырьков представлены на рисунках 1 и 2.
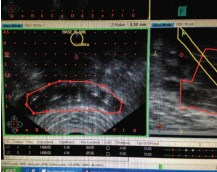
Рис. 1. УЗ-изображения фронтального среза имплантированных интрастатов в семенные пузырьки (планирующая программа PLATO-oncentra)
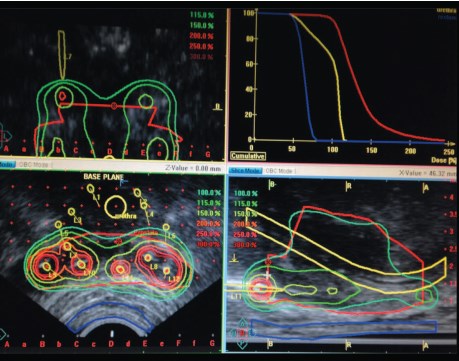
Рис. 2. Дозиметрическое планирование с учетом инвазивного роста опухоли (планирующая программа PLATO-oncentra)
На втором этапе лучевого лечения через 2 недели после брахитерапии пациентам проводилась дистанционная радиотерапия СОД 44-46 Гр в регламенте стандартного фракционирования на зону предстательной железы и регионарного лимфатического оттока.
После лучевого этапа лечения продолжалась андроген-депривационная терапия аналогами ЛГРГ в течение 3-6 месяцев.
НАБЛЮДЕНИЕ
Длительность наблюдения была рассчитана с начала проведения высокомощной брахитерапии. Токсические лучевые реакции оценивались с использованием шкалы Radiation Therapy Oncology Group (RTOG) [13]. Пациенты наблюдались с периодичностью 1 раз в 3 месяца в течение первого года, далее проходили контрольное обследование с интервалами от 3-х до 6-ти месяцев. Медиана наблюдения за пациентами составляла в среднем 42 месяца (диапазон 19-74 месяцев). Контрольное обследование включало определение уровня ПСА крови, урофлоуметрию, лабораторные анализы крови, мочи, УЗИ предстательной железы, мочевого пузыря, заполнение опросников IPSS и IIEF. Биохимический рецидив определялся в соответствии с консенсусом RTOG-ASTRO от 2006 года – рост уровня ПСА на 2нг/мл и выше после достижения минимального уровня маркера [13]. В общей выживаемости оценивались все причины смерти, связанные с основным заболеванием или с другими причинами. Во всех клинических случаях биохимического рецидива проводилась оценка возникновения локальных рецидивов РПЖ, а также диагностика возможных отдаленных метастазов. До лечения проводилась оценка эректильной функции (ЭФ) по опросникам МИЭФ (IIEF). Повторная оценка ЭФ проводилась не ранее чем через 6 месяцев после конца андроген-депривационной терапии.
РЕЗУЛЬТАТЫ
Эффективность За весь период наблюдения из 39 пациентов в 5 случаях выявлен биохимический рецидив. Из них у одного пациента выявлено прогрессирование заболевания в виде метастатического поражения костей скелета, у другого метастатическое поражение костей скелета и легких. У двух пациентов выявлен местный рецидив. У одного пациента выявлен биохимический рецидив (при комплексном обследовании не выявлено данных о наличии местного рецидива или прогрессирования заболевания в виде отдаленных метастазов). За время наблюдения 3 пациента умерли – один из них в связи с прогрессированием основного заболевания, другой умер в результате обострения сердечнососудистой патологии, третий умер от прогрессирования рака поджелудочной железы. Общая выживаемость больных в группе исследования отражена на рисунке 3.
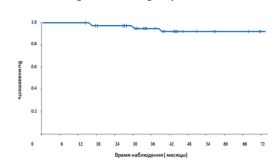
Рис 3. Общая выживаемость больных в группе
Токсичность
При динамическом наблюдении поздние токсические реакции лучевой терапии со стороны мочеполовой системы и прямой кишки III и IV степени отмечены не были. В одном случае отмечался поздний лучевой цистит II степени.
Эректильная функция (ЭФ)
Всем пациентам до проведения комплексного лечения было предложено пройти оценку эректильной дисфункции (ЭД) по опроснику МИЭФ (IIEF). В 5 случаях по причине личностных убеждений мы получили отказ от прохождения тестирования до хирургического вмешательства. После хирургического лечения был получен отказ в трех случаях. Результаты проведения оценки ЭФ представлены в таблице 2.
Таблица 2. Оценка ЭД у пациентов до и после комплексного лечения по опроснику МИЭФ (IIEF)
| Шкала оценки ЭД | Кол-во пациентов до лечения | Кол-во пациентов после лечения |
|---|---|---|
| 26-30 баллов – нет эректильной дисфункции | 8 | 6 |
| 18-25 баллов – легкая степень эректильной дисфункции | 12 | 5 |
| 11-17 баллов – средняя степень эректильной дисфункции | 3 | 2 |
| 6-10 баллов – тяжелая степень эректильной дисфункции | 8 | 18 |
Необходимо отметить, что в исследуемой группе было 20 пациентов, которые вели регулярную половую жизнь и были заинтересованы в сохранении эректильной функции после окончания комплексного лечения. При анализе по опроснику МИЭФ (IIEF) у 12 из них выявлена легкая степень ЭД, у 8 ЭД отсутствовала. При анализе результатов опросника после комплексного лечения сохранная ЭФ наблюдалась у 11 пациентов, что составляет 55% случаев от изначально заинтересованных в сохранении ЭФ. У 6 из них ЭД отсутствовала, у 5 – выявлена легкая степень ЭД.
ОБСУЖДЕНИЕ
Современные радиобиологические данные показывают, что РПЖ имеет низкое соотношение α/β=1,2-3,0 Гр, предполагая, что биологический эффект от эскалации дозы может быть достигнут путем гипофракционированных схем лечения. Брахитерапия высокой мощности дозы оптимально использует радиобиологическое преимущество фракций больших размеров, обеспечивая конформность облучения. Это достигается посредством оптимизации распределения дозы в органе-мишени за счет точного контроля позиционирования источника излучения в режиме реального времени. Оптимизация облучения позволяет снизить лучевую нагрузку на критические органы, минимизируя токсические реакции, как в короткие, так и в отдаленные сроки послеоперационного периода.
В нашем исследовании комплексное лечение в объеме комбинации брахитерапии высокой мощности дозы и дистанционной радиотерапии на фоне проведения андрогендепривационной терапии у больных раком предстательной железы с инвазией в семенные пузырьки, относящиеся к группе крайне высокого риска прогрессирования, показало биохимическую безрецидивную выживаемость в 87% случаев, при медиане наблюдения 42 месяца. Только в двух случаях (5,1%) мы получили местный рецидив опухоли. Учитывая полученные данные, мы считаем, что комплексное лечение с применением брахитерапии высокой мощности дозы в качестве «boost» является эффективным методом лечения при местнораспространенном раке предстательной железы с инвазией в семенные пузырьки. Мы добились подведения необходимой дозы на семенные пузырьки с минимальным процентом лучевых токсических реакций. Только в одном случае (2,5%) мы получили позднее осложнение в виде лучевого цистита II степени. Анализ ЭФ показал, что из 20 пациентов, которые были заинтересованы в сохранении половой жизни после комплексного лечения, у 11 (55%) отмечено сохранение ЭФ. Все пациенты находятся под нашим динамическим наблюдением.
ЗАКЛЮЧЕНИЕ
Наше исследование, в анализ которого были включены данные 39 пациентов с местнораспространенным РПЖ с вовлечением в процесс семенных пузырьков, продемонстрировало, что брахитерапия высокой мощной дозы Ir192 является эффективным методом экскалации дозы при проведении радиотерапии. Количество ранних и поздних лучевых токсических реакций при этом минимально, а сохранение ЭФ отмечено более чем в 50% случаев у пациентов, живших активной половой жизнью до лечения с отсутствием и легкой формой ЭД. Таким образом, брахитерапия высокой мощной дозы в сочетании с дистанционной лучевой терапией и андроген-депривационной терапией может расцениваться как эффективный метод лечения больных, страдающих раком предстательной железы с инвазией в семенные пузырьки.
ЛИТЕРАТУРА
1. Deutsch I, Zelefsky MJ, Zhang Z, Mo Q, Zaider M, Cohen G, et al. Comparison of PSA relapse-free survival in patients treated with ultra-high-dose IMRT versus combination HDR brachytherapy and IMRT. Brachytherapy 2010;9(4):313-318.
2. Lee L., Stock R., Stone N. Role of hormonal therapy in the management of intermediateto high-risk prostate cancer treated with permanent radioactive seed implantation. Int J Radiat Oncol Biol Phys 2002;52(2):444–452.
3. Grimm P, Billiet I, Bostwick D, Dicker AP, Frank S, Immerzeel J, et. al. Comparative analysis of prostate-specific antigen free survival outcomes for patients with low, intermediate and high risk prostate cancer treatment by radical therapy. Results from the Prostate Cancer Results Study Group. BJU Int 2012;109(Suppl 1):22–29.
4. Prada PJ, Mendez L, Fernández J, González H, Jiménez I, Arrojo E. Long-term biochemical results a?er high-dose-rate intensity-modulated brachytherapy with external beam radiotherapy for high risk prostate cancer. Radiat Oncol 2012;7:31-33.
5. Bolla M, Collette L, Blank L, Warde P, Dubois JB, Mirimanoff RO, et al. Long-term results with immediate androgen suppression and external irradiation in patients with locally advanced prostate cancer (an EORTC study): a phase III randomised trial. Lancet 2002;360(9327):103-106.
6. Horwitz EM, Bae K, Hanks GE, Porter A, Grignon DJ, Brereton HD, et al. Ten-year follow-up of radiation therapy oncology group protocol 92-02: a phase III trial of the duration of elective androgen deprivation in locally advanced prostate cancer. J Clin Oncol 2008;26(15):2497-2504.
7. Widmark A, Klepp O, Solberg A, Damber JE, Angelsen A, Fransson P, et al. Endocrine treatment, with or without radiotherapy, in locally advanced prostate cancer (SPCG-7/SFUO-3): an open randomised phase III trial. Lancet 2009;373(9660):301-308.
8. Challapalli A, Jones E, Harvey C, Hellawell GO, Mangar SA. High dose rate prostate brachytherapy: an overview of the rationale, experience and emerging applications in the treatment of prostate cancer. Br J Radiol 2012;85(1):18–27.
9. Kuban DA, Tucker SL, Dong L, Starkschall G, Huang EH, Cheung MR, et al. Long-term results of the M. D. Anderson randomized dose-escalation trial for prostate cancer. Int J Radiat Oncol Biol Phys 2008;70(1):67–74.
10. Dearnaley D, Syndikus I, Sumo G, Bidmead M, Bloomfield D, Clark C, et al. Conventional versus hypofractionated high-dose intensity modulated radiotherapy for prostate cancer: preliminary safety results from the CHHiP randomised controlled trial. Lancet Oncol 2012;13(1):43-54.
11. Mottet N, Bellmunt J, Briers E, van den Berg RCN, Bolla M, van Casteren NJ, et. al. European Association of Urology Guidelines on Prostate Cancer 2015. Available from: https://uroweb.org/wp-content/uploads/09-Prostate-Cancer_LR.pdf
12. NCCN The National Comprehensive Cancer Network, Prostatecancer 2015. Available from: https://www.nccn.org/patients/guidelines/prostate/files/assets/basic-html/page-1.html#
13. Cox J., Stetz J., Pajak T. Toxicity criteria of the Radiation ?erapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat Oncol Biol Phys 1995;31(5):1341-345
14. Roach M 3rd, Hanks G, ?ames H Jr, Schellhammer P, Shipley WU, Sokol GH, et al. Defining biochemical failure following radiotherapy with or without hormonal therapy in men with clinically localized prostate cancer: recommendations of the RTOG-ASTRO Phoenix Consensus Conference. Int J Radiat Oncol Biol Phys 2006;65(4):965-974.
Журнал "Экспериментальная и клиническая урология" Выпуск № 3 за 2016 год









Комментарии