Журнал "Экспериментальная и клиническая урология" Выпуск №1 за 2014 год
Тетерина Т.А., Аполихина И.А.,Глыбочко П.В., Безнощенко Кречетова Л.В., О.С., Миркин Я.Б.,
Хроническое воспаление мочевого пузыря сопровождается инфильтрацией стенки мочевого пузыря мононуклеарами (макрофагами, лимфоцитами, тучными и плазматическими клетками), приводящей к необратимым изменениям в его тканях – фиброзу, гиперактивности детрузора и гипералгезии [1].
Слизистая оболочка мочевого пузыря, постоянно подвергающаяся растяжению и сокращениям, покрыта уротелием, который содержит многочисленные рецепторы и уроплакины, и выполняет защитную функцию [2, 3].
В структуре уротелия имеется слой гликозаминогликан–хондроитин сульфатов, гиалуроната натрия, гликопротеинов и муцинов для защиты от повреждающих факторов и предотвращения адгезии уропатогенов к уротелию. Его повреждение сопровождается кровоизлиянием и продукцией цитокинов, запускающих пролиферацию и активацию тучных клеток [4, 5, 6, 7].
В последнее время как в отечественной, так и в зарубежной литературе большое внимание уделяется изучению цитокинов – биологически активных веществ белковой природы, выполняющих медиаторные функции в развитии ряда патологических процессов, в том числе воспаления. Некоторые цитокины, в частности интерлейкин 1β (ИЛ-1β), интерлейкин 8 (ИЛ-8), фактор некроза опухоли α (ФНО-α), имеют доказанную провоспалительную активность, повышение их концентрации в крови и биологических жидкостях является маркером воспалительного процесса. ИЛ – 8, секретируемый
клетками мочевого пузыря и почек, играет важную роль в активации миграции нейтрофилов при внедрении уропатогенов [8, 9]. Пик экспрессии большинства цитокинов и хемокинов достигается примерно через 24 ч после внедрения уропатогена, и возвращается к исходным показателям через 2 недели [9]. ИЛ-8 относится к СХСхемокинам и является мощным хемотаксическим и активирующим фактором для нейтрофилов. Это самый ранний провоспалительный цитокин, продуцируемый многими клетками, включая моноциты, макрофаги, Т-клетки, нейтрофилы, фибробласты, эндотелиальные клетки, кератиноциты, гепатоциты, астроциты и хондроциты. Наряду с другими цитокинами, ИЛ8 участвует в процессах стимуляции и дегрануляции лейкоцитов, ангиогенезе, способствует миграции фагоцитов в очаг воспаления и, по мнению ряда авторов [4, 6, 7, 9], может иметь диагностическое значение при инфекциях урогенитального тракта.
Повышение концентрации ИЛ – 8 в моче может являться маркером воспаления не только при хроническом цистите, но и латентного воспаления у пациентов с симптомами гиперактивного мочевого пузыря (ГМП). По мнению некоторых исследователей, определение уровня данного интерлейкина целесообразно включать в алгоритм обследования пациенток с ГМП для выбора оптимальной и эффективной патогенетически обоснованной терапии [10].
В последние годы появляется все больше данных, подтверждающих инфекционную этиологию ГМП. Впервые в исследовании Khasriya RK. et al. [11], а затем другими исследователями, было выявлено, что внутриклеточная бактериальная колонизация может быть причиной ГМП.
В настоящее время многими исследователями [15, 16, 17, 18, 19] также предлагается рассматривать мочевой фактор роста нервов (м – ФРН) в качестве биомаркера ГМП. М – ФРН – это нейротрофический фактор, продуцируемый уротелием и гладкомышечными клетками.
Хроническое воспаление сопровождается повышением секреции м-ФРН у пациентов с ГМП и детрузорной гиперактивностью, приводящим к морфологическим изменениям в системе чувствительных и двигательных нейронов мочевого пузыря и, следовательно, к детрузорной гиперактивности [12, 13, 14]. Считается, что м-ФРН играет ключевую роль в корреляции между воспалением и болевой импульсацией, так как он продуцируется клетками уротелия, гладкомышечными и тучными клетками, при этом активируя их дегрануляцию и пролиферацию [15].
В многочисленных исследованиях повышенный уровень м-ФРН обнаружен при таких заболеваниях, как ГМП, интерстициальный цистит и простатит [8, 16, 17, 18, 19].
Некоторыми авторами [8, 16, 17] высказано мнение о том, что уровень м-ФРН может играть важную роль во взаимосвязи между субуротелиальными чувствительными волокнами и гиперчувствительностью детрузора. Также м-ФРН является медиатором в модуляции уротелиального ответа на воспаление и порога восприятия ургентности.
В последнее время в медицинской литературе все чаще появляется термин «резистентный гиперактивный мочевой пузырь», характеризующийся сохранением симптоматики после проведения пациенткой лечения более, чем двумя М – холиноблокаторами с тренировкой мочевого пузыря в течение более 1 года [20].
Liu HT. et al. [19] исследовали уровень м-ФРН в сыворотке крови и моче 34 женщин, страдающих резистентным ГМП. Было выявлено значительное повышение уровня м-ФРН в сыворотке и моче по сравнению с контрольной группой (31 здоровая женщина). Значимых отличий в уровне м-ФРН среди женщин с «сухим» и «мокрым» типами ГМП не выявлено. Также после трехмесячного курса лечения солифенацином уровень мФРН оставался стабильно высоким, вследствие чего авторы сделали предположение, что резистентный ГМП может быть вызван хронической инфекций.
Исходя из изложенного, целью нашего исследования было изучить роль маркеров воспаления и пролиферации (ИЛ-8 и м-ФРН) в диагностике резистентного ГМП.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективное рандомизированное сравнительное открытое исследование были включены 79 женщин, из которых у 32 подтвержден диагноз резистентного ГМП, а у 47 – был хронический неспецифический бактериальный цистит. С использованием таблицы случайных чисел была проведена блочная рандомизация, вследствие чего пациентки были разделены на 4 группы:
I группа – 19 женщин с хроническим циститом, которым был проведен 10-дневный курс антибактериальной терапии с учетом чувствительности микроорганизма, после которого произведены 4 внутрипузырные инстилляции гиалуроната натрия по 1 процедуре в неделю. При этом 7 (36,8%) пациенток получали левофлоксацин по 500 мг 1 раз в день внутрь, 11 (57,9%) – цефиксим по 400 мг 1 раз в день внутрь и 1 (5,3%) – монурал 3,0 г внутрь однократно в сочетании с нитрофурантоином по 100 мг 2 раза в день в течение 7 дней (в связи с наличием микст-инфекции и разной чувствительности микроорганизмов).
II группа – 28 женщин с хроническим циститом, которым был проведен только 10-дневный курс антибактериальной терапии с учетом чувствительности микроорганизма: 11 (39,3%) пациенток принимали левофлоксацин по 500 мг 1 раз в день внутрь и 16 (57,1%) – цефиксим по 400 мг 1 раз в день внутрь.
III группа – 17 женщин с резистентным ГМП, которым была проведена комплексная терапия антибактериальными препаратами и курс из 4-х внутрипузырных инстилляций гиалуроната натрия. 7 (41,2%) пациенткам был назначен 10-дневный курс левофлоксацина по 500 мг 1 раз в день внутрь и 10 (58,8%) – 10-дневный курс цефиксима по 400 мг 1 раз в день внутрь.
IV группа – 15 женщин с резистентным ГМП получили только 10дневный курс антибактериальной терапии с учетом чувствительности микроорганизма. При этом 6 (40%) принимали левофлоксацин по 500 мг 1 раз в день внутрь и 9 (60%) – цефиксим по 400 мг 1 раз в день внутрь.
Всем 36 пациенткам I и III групп назначали курс из 4-5 внутрипузырных введений раствора гиалуроната натрия по 50 мл 1 раз в неделю. После самостоятельного опорожнения мочевого пузыря и обработки наружных половых органов 0,2% раствором октенисепта проводили катетеризацию мочевого пузыря стерильным уретральным катетером. После введения раствора гиалуроната натрия пациенткам рекомендовали не опорожнять мочевой пузырь в течение 1 – 2-х часов для увеличения времени экспозиции препарата.
Во всех группах проводилось динамическое наблюдение через 2 недели, 6 и 12 мес после проведенного лечения.
Для количественного определения м-ФРН и ИЛ-8 было отобрано 313 образцов мочи, из них 80 образцов мочи женщин контрольной группы (средний возраст 36,5±13,3 лет), не имеющих в анамнезе и в момент обследования заболеваний урогенитального тракта и признаков инфекции мочевыводящих путей по данным экспресс-теста; 79 образцов мочи женщин исследуемых групп до начала терапии и затем через 2 недели и 6 мес после лечения (4 пациентки не явились на 3-й визит), (всего 233 пробы). Забор мочи осуществлялся в стерильную пробирку объемом 10 мл, после чего полученные биообразцы на льду в течение 15-20 мин доставлялись в лабораторию. Образцы центрифугировались в течение 10 мин при 3000 об/мин и температуре 4оС. Для хранения супернатанты разливали в пробирки типа «Эппендорф» по 1мл, хранили до анализа при температуре минус 80 оС.
Для количественного определения м-ФРН в моче использовали набор Human beta-NGF (beta nerve growth factor) ELISA, RayBio (США).
Для определения ИЛ-8 в моче использовали набор реагентов для иммуноферментного определения концентрации интерлейкина-8 в сыворотке крови и моче, ВекторБест (Россия).
Измерение оптической плотности (ОП) в обоих случаях проводилось с помощью планшетного спектрофотометра Expert plus (Австрия).
При описании полученных результатов определяли среднее арифметическое (М), ошибку среднего (m), среднее квадратичное отклонение (σ), частоты встречаемости качественных признаков (%, доли единицы), ассиметрию и эксцесс с их ошибками, моду, медиану, квантили и 10-й с 90-м персентилем. Показатели асимметрии и эксцесса позволили оценить характер распределения, в первую очередь, его принадлежность к нормальному.
Достоверность различий между группами по количественным признакам оценивали с помощью непараметрических критериев Краскала-Уоллиса и Манна-Уитни. Для определения различий между номинальными показателями (%) использовали критерий Пирсона Хиквадрат и точный критерий Фишера для малых выборок. В случае последовательных измерений одного и того же пациента использовались критерии Фридмана и Вилкоксона для парных случаев, а так же критерий Мак-Немара. Различия между сравниваемыми величинами признавалось значимыми при р< 0,05. Учитывался эффект множественных сравнений.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Результаты исследования концентрации ИЛ-8 в моче
Измерение концентрации ИЛ-8 в моче имеет диагностическое значение при инфекциях урогенитального тракта [4, 6, 7, 9]. Мониторинг содержания этого показателя в моче позволяет оценить степень выраженности воспалительного процесса, поэтому мы исследовали уровень ИЛ-8 у пациенток с резистентным ГМП и хроническим циститом в сравнении со здоровыми женщинами и в динамике для оценки эффективности проводимого лечения.
Нами было установлено, что в группе женщин с хроническим циститом уровень ИЛ-8 в моче был в 2,4 раза выше, чем в контрольной группе, а в группе с резистентным ГМП – в 1,7 раза (р < 0,05). Таким образом, мы сделали вывод о наличии и ведущей роли воспалительного компонента не только при хроническом цистите, но и при резистентном ГМП (табл. 1).
При делении на 4 группы с учетом проведения внутрипузырных инстилляций гиалуроната натрия статистически значимых различий между группами не выявлено. Отсутствие статистически значимых результатов в данном случае связано, по-видимому, с небольшим количеством пациенток в группах.
Всем пациенткам был проведен вышеописанный курс лечения, включающий антибактериальную терапию с учетом чувствительности микроорганизма, и 4 внутрипузырные инстилляции гиалуроната натрия у пациенток групп 1 и 3.
Через 2 нед и через 6 мес после проведенной терапии у всех пациенток была повторно исследована концентрация ИЛ8 в моче (табл. 2).
Выявлено статистически значимое снижение концентрации ИЛ-8 в моче пациенток исследуемых групп на 2 и 3 визите было по сравнению с исходной концентрацией.
Отмечалось статистически значимая положительная динамика изменения концентрации ИЛ-8 в динамике в I и II группах женщин с хроническим циститом (рис. 1), в то время как в III и IV группах с резистентным ГМП статистически значимой разницы не обнаружено, однако отмечается тенденция к уменьшению уровня ИЛ-8 (рис. 2). Данный факт может быть ния антибактериальной и терапии гиалуронатом натрия, снижением эффективности последнего в динамике с течением времени.
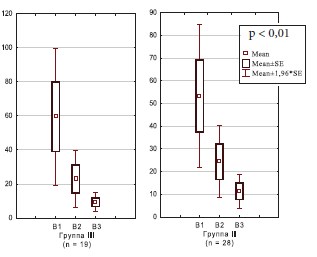
Рис. 1. Динамика концентрации ИЛ-8 в моче у женщин с хроническим циститом (n = 47)
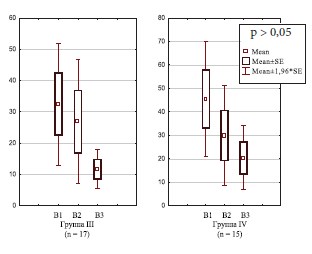
Рис. 2. Динамика концентрации ИЛ-8 в моче у женщин с резистентным ГМП (n = 32)
В I группе женщин наблюдалось снижение концентрации ИЛ-8 в моче в 6 раз (с 59,5±5 до 9,4±2,8 пг/мл), во II группе – в 4,7 раза (с 53,3±16 до 11,3±3,8 пг/мл), в 3 группе – в 3,9 раза (с 45,4±12,5 до 11,7±3,2 пг/мл) и в 4-й – в 1,6 раза (с 32,5±9,9 до 20,5±6,9 пг/мл) (р < 0,01). Таким образом, в I и III группах пациенток эффективность проведенной терапии оказалась статистически значимо выше, чем во II и IV, что, вероятно, связано с проведением курса терапии гиалуронатом натрия, приводящего к восстановлению поврежденного слоя уротелия.
При проведении корреляционного анализа также была обнаружена слабая прямая зависимость между концентрацией ИЛ-8 в моче и количеством лейкоцитов в моче (r = 0,25; p < 0,05). Таким образом, нами было отмечено, что при повышении лейкоцитов в моче увеличивается концентрация ИЛ-8, что еще раз подтверждает инфекционно-воспалительный генез заболеваний.
Таблица 1. Значения ИЛ-8 в моче пациенток исследуемых групп до лечения
| Исследуемый параметр | Группа I (ХЦ+ГК) (n = 19) |
Группа II (ХЦ) (n = 28) |
Группа III (рГМП+ГК) (n = 17) |
Группа IV (рГМП) (n = 15) |
Контроль (n = 80) |
|---|---|---|---|---|---|
| Концентрация ИЛ-8, пг/мл |
59,5±20,5 | 53,3±16 | 45,4±12,5 | 32,5±9,9 | 23,7±2,9 |
Примечание. Данные представлены как среднее ± стандартное отклонение; ХЦ – хронический цистит рГМП – резистентный ГМП; ГК – инстилляции гиалуроновой кислоты; n – количество пациенток
Таблица 2. Концентрация ИЛ-8 в моче пациенток исследуемых групп после лечения
| Группа пациенток | Визит 2 (через 2 недели после лечения), пг/мл |
Визит 3 (через 6 месяцев после лечения), пг/мл |
|---|---|---|
| I (ХЦ+ГК) (n = 19) | 23,1±8,5 | 9,4±2,8 |
| II (ХЦ) (n = 28) | 24,5±8 | 11,3±3,8 |
| III (рГМП+ГК) (n = 17) | 29,9±10,8 | 11,7±3,2 |
| IV (рГМП) (n = 15) | 26,9±10,1 | 20,5±6,9 |
Примечание. Данные представлены как среднее ± стандартное отклонение; ХЦ – хронический цистит;
рГМП – резистентный ГМП; ГК – инстилляции гиалуроновой кислоты; n – количество пациенток
Результаты исследования концентрации м-ФРН в моче
Увеличение уровня м-ФРН отмечается в ткани мочевого пузыря и в образцах мочи у пациентов с ГМП. Уровень м-ФРН может рассматриваться в качестве значимого биомаркера для диагностики и мониторирования прогрессии ГМП. Также в многочисленных исследованиях обсуждается роль м-ФРН в качестве маркера воспаления.
В нашем исследовании средние значения м-ФРН были нормированы на концентрацию креатинина в моче по формуле: м-ФРНн= м-ФРН/ креатинин.
При оценке полученных данных установлено, что концентрация м-ФРН до лечения в группах пациенток статистически значимо не различалась (табл. 3), что может подтверждать наше предположение о роли воспалительной реакции при резистентном ГМП как и при хроническом цистите. Отсутствие различий концентрации данного биомаркера, возможно, свидетельствует об одинаковой степени выраженности процесса в тканях при данных состояниях.
Сравнительный анализ уровня мФРН после лечения в исследуемых группах также не выявил статистически значимых различий.
Тем не менее, в I и III группах женщин, в комплекс терапии которых входили по 4 внутрипузырные инстилляции гиалуроната натрия, нами была обнаружена тенденция к некоторому увеличению экспрессии м-ФРН, а в группах без назначения инстилляций гиалуроновой кислоты – наоборот, к уменьшению. В некоторых исследованиях показано, что экспрессия м-ФРН увеличивается при воспалительных заболеваниях, при которых он может играть роль ингибитора воспалительного процесса [21]. Однако при сравнительной суммарной оценке динамики изменения концентрации м-ФРН статистически значимых различий между группами нами не выявлено (рис. 3).
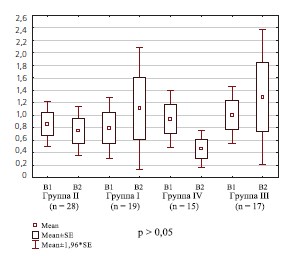
Рис.3. Концентрация м-ФРН у женщин исследуемых групп до и после лечения
При проведении корреляционного анализа Спирмена была обнаружена слабая прямая зависимость между концентрацией м-ФРН в моче и длительностью заболевания (r = 0,27; p < 0,05), а также умеренная прямая зависимость между концентрацией м-ФРН в моче и количеством рецидивов в год после лечения (r = 0,34; p < 0,05). Таким образом, нами было отмечено, что чем длительнее период заболевания, тем выше концентрация м-ФРН в моче, и тем больше количество рецидивов.
ОБСУЖДЕНИЕ
В своей работе мы сочли целесообразным включить определение концентрации ИЛ-8 в моче в перечень обследования пациенток и обнаружили, что в обеих исследуемых группах уровень ИЛ-8 в моче был в 2 раза выше, чем в контрольной группе. Таким образом, мы сделали вывод о наличии и ведущей роли воспалительного компонента не только при хроническом цистите, но и при рГМП. Немаловажным является и тот факт, что при повышении лейкоцитов в моче увеличивается концентрация ИЛ-8, что еще раз подтверждает инфекционно-воспалительный генез заболеваний.
В многочисленных исследованиях обсуждается роль м-ФРН в качестве маркера воспаления [16, 17, 18, 19]. При анализе собственных результатов относительно концентрации м-ФРН до лечения в группах пациенток значимых различий не отмечалось, что может подтверждать наше предположение о роли воспалительной реакции при рГМП как и при хроническом цистите. Также нами было отмечено, что чем длительнее период заболевания, тем выше концентрация м-ФРН в моче, и тем больше количество рецидивов наблюдается после проведенного лечения. Таким образом, определение мочевого уровня м-ФРН может рассматриваться как значимый биомаркер для диагностики и мониторирования прогрессии ГМП, а также прогнозирования эффективности лечения хронического цистита.
При сравнительной оценке концентрации ИЛ-8 в динамике до и после лечения в группах женщин с хроническим циститом мы отметили статистически значимую положительную динамику. Несмотря на то, что у пациенток с рГМП также отмечается тенденция к уменьшению уровня ИЛ-8, однако статистически значимой разницы не обнаружено. Данный факт может быть обусловлен недостаточностью проведения курсов антибактериальной и терапии гиалуронатом натрия, снижением эффективности последнего в динамике с течением времени. Кроме того, в группах пациенток, которым проводилась комбинированная терапия, эффективность оказалась статистически значимо выше, что, вероятно, связано с проведением курса терапии гиалуронатом натрия, который восстанавливает поврежденный слой уротелия.
Однако при анализе изменения концентрации м-ФРН в группах женщин, в комплекс терапии которых входили 4 внутрипузырные инстилляции гиалуроната натрия, нами была обнаружена тенденция к некоторому увеличению экспрессии мФРН, а в группах без назначения инстилляций гиалуроновой кислоты – наоборот, к уменьшению. В некоторых исследованиях показано, экспрессия м-ФРН увеличивается при воспалительных заболеваниях, при которых он играет роль ингибитора воспаления [21].
Таблица 3. Концентрация м-ФРНн в исследуемых группах
| Группа пациенток | Концентрация м-ФРНн до лечения, пг/мл |
Концентрация м-ФРНн после лечения, пг/мл |
|---|---|---|
| I (ХЦ+ГК) (n = 19) | 0,8±0,3 | 1,1±0,5 |
| II (ХЦ) (n = 28) | 0,9±0,2 | 0,8±0,2 |
| III (рГМП+ГК) (n = 17) | 1±0,2 | 1,3±0,5 |
| IV (рГМП) (n = 15) | 0,9±0,2 | 0,5±0,2 |
Примечание. Данные представлены как среднее ± стандартное отклонение; n – число пациенток в групп;
ХЦ – хронический цистит, ГК – гиалуроновая кислота, рГМП – резистентный ГМП
Таким образом, применение внутрипузырных инстилляций гиалуроната натрия в комплексной терапии хронического цистита и резистентного ГМП значительно повышает эффективность лечения. Комбинированная терапия должна проводиться поэтапно: I этап – 10-дневный курс антибактериальной терапии, выбор антибиотика осуществляется согласно чувствительности выделенного микроорганизма по данным культурального исследования мочи и наличия урогенитальной инфекции при исследовании отделяемого уретры методом ПЦР, затем II этап – курс из 4 – 5 внутрипузырных введений раствора гиалуроната натрия по 50 мл 1 раз в неделю. В связи с тем, что данная терапия недостаточно купирует некоторые симптомы резистентного ГМП (ургентность, количество мочеиспусканий), вероятно, необходимо проведение дополнительных методов лечения на последующих этапах (длительный прием М-холиноблокаторов, нейростимуляция, тренировка мочевого пузыря и мышц тазового дна и др.). При этом на начальном этапе ведения пациенток с резистентным ГМП, как и с хроническим циститом, необходимо проведение именно патогенетически обоснованной комбинированной терапии, состоящей из 10-дневного курса антибактериальной терапии и 4-5 внутрипузырных инстилляций гиалуроната натрия.
ЗАКЛЮЧЕНИЕ
Определение маркеров воспаления и пролиферации (ИЛ-8 и м-ФРН) в моче может быть рекомендовано для использования в качестве диагностических критериев и мониторирования резистентного ГМП, а также прогнозирования эффективности терапии как хронического цистита, так и резистентного ГМП.
ЛИТЕРАТУРА
1. Grover S, Srivastava A, Lee R, Tewari AK, Te AE. Role of inflammation in bladder function and interstitial cystitis. // Ther Adv Urol. 2011. Vol. 3, N 1. P. 19 – 33.
2. Apodaka G. The uroepithelium: not just a passive barrier. // Traffic. 2004. Vol. 5, N 3. P. 117 – 128.
3. Parsons CL. The role of the urinary epithelium in the pathogenesis of interstitial cystitis/ prostatitis/ urethritis. // Urol. 2007. Vol. 69, Suppl. 4. P. 9 – 16.
4. Graham E, Chai TC. Dysfunction of bladder urothelium and bladder urothelial cells in inrestitial cystitis.// Curr Urol Rep. 2006. Vol. 7, N 6. P. 440 – 446.
5. Sivick KE, Mobley HL. Waging war against uropathogenic Escherichia coli: winning back the urinary tract (minireview). // Infect Immun. 2010. Vol. 78, N 2. P. 568 – 585.
6. Hurst RE. Structure, function and pathology of proteoglycans and glycosaminoglycans in the urinary tract. // World J Urol. 1994. Vol. 12, N 1. P. 3 – 10.
7. Lilly JD, Parsons CL. Bladder surface glycosaminoglycans is a human epithelial permeability barrier. // Surg Gynec Obstet. 1990. Vol. 171. P. 2543 – 2551.
8. Janeway C. Immunobiology: the immune system in health and disease, 6th edition. Garland Science, New York, NY; 2005. 566 p.
9. Ingersoll MA, Kline KA, Nielsen HV, Hultgren SJ. G – CSF induction early in uropathogenic E. coli infection of the urinary tract modulates host immunity. // Cell Microbiol. 2008. Vol. 10, N 12. P. 2568 – 2578.
10. Лесовой В.Н., Гарагатый И.А., Колупаев С.М., Колупаева Л.С. Диагностическое значение определения уровня провоспалительных цитокинов в моче больных гиперактивным мочевым пузырем. // Экспериментальная и клиническая медицина. 2011. N 2. C. 159 – 161.
11. Khasriya RK., Ismail S, Wilson M, Malonee-Lee. A new aethiology for OAB: intracellular bacterial colonization of urothelial cells. // Intern J Urogynecol. 2011. Vol. 22, Suppl 1. P. 141 – 142.
12. Yin X, Hou T, Liu Y, Chen J, Yao Z, Ma C, Yang L, Wei L. Association of Tolllike receptor 4 gene polymorphism and expression with urinary tract infection types in adults. PLoS ONE. 2010. Vol. 5, N 12. P. 14223
13. Bishop BL, Duncan MJ, Song J, Li G, Zaas D, Abraham SN. Cyclic AMP – regulated exocytosis of Escherichia coli from infected bladder epithelial cells. // Nat Med. 2007. Vol. 13, N5. P. 625 – 630.
14. Song J, Bishop BL, Li G, Duncan MJ, Abraham SN. TLR4 initiated and cAMP mediated abrogation of bacterial invasion of the bladder. // Cell Host Microbe. 2007. Vol. 1, N 4. P. 287 – 298.
15. Steers WD, Kolbeck S, Creedon D, Tuttle JB. Nerve growth factor in the urinary bladder of the adult regulates neuronal form and functions. // J Clin Invest. 1991. Vol. 88. P. 1709 – 1715.
16. Liu HT, Kuo HC. Intravesical botiulinum toxin A injections plus hydrodistention can reduse nerve growth factor production and control bladder pain in interstitial cystitis. // Urol. 2007. Vol. 70. P. 463 – 468.
17. Kim JC, Park EY. Nerve growth factor and prostaglandins in the urine of female patient with overactive bladder. // J Urol. 2006. Vol. 175. P. 1773 – 1776.
18. Liu HT, Kuo HC. Urinary nerve growth factor level could be a potential biomarker for diagnosis of overactive bladder. // J Urol. 2008. Vol. 179. P. 2270 – 2274.
19. Liu HT, Chancellor MB, Kuo HC. Urinary nerve growth factor levels are elevated in patients with detrusor overactivity and decreased in responders to detrusor botulinum toxin A injection. // Eur Urol. 2009. Vol. 56. P. 700706.
20. Walsh CA, Cheng Y, Siddins A, Mansfield K. et al. Low – count bacteriuria and its relationship to ATP release in refractory detrusor overactivity. // Intern J Urogynecol. 2011. Vol. 25. P. 11– 15.
21. Ochodnický P, Cruz CD, Yoshimura N, Michel MC. Nerve growth factor in bladder dysfunction: Contributing factor, biomarker, and therapeutic target. // Neurourol Urodynamics. 2011. Vol. 30, N 7. P. 1227–1241.









Комментарии