Косовцова Н.В., Маркова Т.В., Башмакова Н.В., Чистяков М.А.
В последнее десятилетие отмечается рост числа обструктивных заболеваний почек, этиопатогенез которых непосредственно связан с патологией антенатального развития [1]. По данным отечественных авторов, доля врожденных пороков развития мочевыделительной системы, в том числе проявляющиеся обструкцией мочевыводящих путей, в структуре хронической почечной недостаточности у детей достигает 65% [2]. Многообразие и высокая распространенность пороков органов мочевыделения, заставляют рассматривать проблему существования указанных пороков с точки зрения профилактики их осложнений.
На экспериментальных моделях плодов животных было показано, что при мочеточниковой или уретральной обструкции развивается дисплазия почек, и внутриутробная декомпрессия предотвращает аномалии почечной дифференцировки [3]. Опытным путем было доказано, что функция почек новорожденных ягнят была прямо пропорциональна продолжительности внутренней декомпрессии и обратно пропорциональна продолжительности обструкции. Изменения в почечной паренхиме и функции почек сохранялись и после рождения и непосредственно зависели от продолжительности компрессии в мочевыделительном тракте [4]. Интерстициальный фиброз почечной паренхимы является общим результатом длительной обструкции мочеточника [5]. Данные исследования и развитие методов пренатальной хирургии позволили внутриутробно дренировать мочевыделительную систему. Наиболее часто устанавливается везикоамниальный шунт при синдроме задних уретральных клапанов и атрезии уретры. В Европе в 2007 году было проведено многоцентровое, рандомизированное, контролируемое исследование (Percutaneous shunting for Lower Urinary Tract Obstruction randomized controlled trial [PLUTO]), которое доказало, что пренатальное везикоамниальное шунтирование улучшает функцию почек и в конечном итоге — перинатальные исходы [6]. Тем не менее, до сих пор в доступной нам литературе нет данных о морфологических изменениях и исходе раневого процесса в почках плодов, подвергнутых внутриутробному стентированию.
Цель: доказать безопасность шунтирующих операций почек плодов, изучив патоморфологические изменения в почках плодов экспериментальных животных стентом, разработанным в ФГБУ «НИИ ОММ» Минздрава России г. Екатеринбург, для шунтирования почек плода при обструктивных пороках развития мочевыделительной системы.
Задачи:
- Изучить органометрические показатели шунтированных и контрлатеральных почек плодов экспериментальных животных;
- Описать морфологические изменения в шунтированных почках;
- Провести морфометрию структурных элементов и сравнить морфометрические показатели стентированных и контрлатеральных почек плодов экспериментальных животных;
- Определить долю раневого канала и его стенки в почке.
МАТЕРИАЛЫ И МЕТОДЫ
Разработанные в ФГБУ «НИИ ОММ» МЗ РФ стенты были введены малоинвазивным методом под контролем ультразвуковой визуализации под общим обезболиванием в лоханку правых почек трём развивающимся плодам овец. Через 30 календарных дней (срок гестации составил 75-85дней) были извлечены плоды (рис.1). Шунтированные правые почки (n=3) составили основную группу. Контрлатеральные почки плодов (n) отнесли в группу сравнения. Проведение данного эксперимента утверждено этическим комитетом ФГБУ «НИИ ОММ» МЗ РФ.
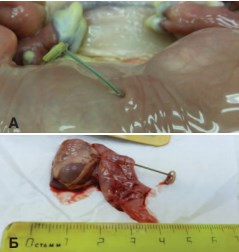
Рис.1.Стент нефро-амниальный. А.Общий вид. Б. Стент в почке плода
Осуществлялась органометрия почек: длина от верхнего до нижнего полюса (см), ширина от ворот почки по поперечной оси (см), толщина — наибольший показатель в передне-заднем направлении (см), вес (г). Масса органа измерялась на электронных весах с погрешностью 1гр. Линейные параметры органа измерялись при помощи ученической линейки (цена деления 0,1см).
Для последующего микроскопического исследования из почек основной группы забирались кусочки, вырезанные в поперечной плоскости относительно оси стоящего стента. Таким образом, поперечное сечение стента и раневой канал оказались доступны для гистологического изучения. Набор кусочков для гистологического исследования из контрлатеральных почек проводился в поперечной плоскости от воображаемой линии прохождения стента, аналогичной почке основной группы. Кусочки фиксировались в 10% растворе нейтрального формалина. Изготовление гистопрепаратов проводилось по стандартной гистологической методике. Гистологические срезы окрашивали гематоксилином и эозином, пикрофуксином по ван Гизону [7].
Изучались общепатологические процессы в почках. Применили морфометрический метод по определению доли структурных элементов в почках плодов овец в гистологических срезах при помощи сетки Г.Г. Автандилова с равноудаленными 25 точками в 30 полях зрения ув.х400 в каждом срезе с шагом 1 мм. [8].
В изучаемых группах почек подвергали морфометрии следующие структурные единицы: 1) почечное тельце; 2) проксимальные и дистальные извитые канальцы; 3) прямые канальцы, петля Генле и собирательные трубочки; 4) волокнистая соединительная ткань стромы; 5) сосуды; 6) раневой канал; 7) стенка фиброзная раневого канала; 8) лейкоцитарная инфильтрация.
Полученные результаты обрабатывались при помощи статистических программ Miсrosoft Exsel 2010, с вычислением, M, m, p.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Почки подов овец после извлечения были коричневого цвета с эмбриональной дольчатостью. В правых почках в лоханках через паренхиму был установленный внутриутробно стент. Размеры стентированных почек в основной группе не имели значимых различий от таковых в группе сравнения (табл. 1). Масса стентированных почек была 5,83±1,5 г, масса нестентированных почек — 5,9±1,5 г, при этом достоверных различий не выявлено (р<0,05).
Таблица 1. Размеры почек (см, М±m)
| Показатель | Длина | Ширина | Толщина |
|---|---|---|---|
| Шунтированные почки | 3,066±0,1* | 1,93±0,62* | 1,56±0,72* |
| Нестентированные почки | 3,033±0,05 | 2,16±0,73 | 1,66±0,67 |
Микроскопическое исследование почек группы сравнения показало, что в корковом слое имеются развитые почечные тельца с извитыми капиллярами, которые заполняют почти всю капсулу. Субкапсулярно расположено небольшое количество эмбриональных почечных телец с каналикулярным строением. Вокруг почечных телец множество извитых канальцев. Пирамиды с обычным строением, в которых определяются прямые канальцы, петли Генле и выводящие канальцы, а также волокнистая строма и полнокровные сосуды (рис. 2).
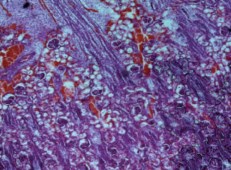
Рис. 2. Почка группы сравнения. Развитые мозговой и корковый слои. Субкапсулярно расположено небольшое количество эмбриональных почечных телец с каналикулярным строением. Окраска гематокслином и эозином. Ув.х40
Стентированные почки морфологически имели некоторые особенности. В паренхиме определялась стенка раневого канала, которая представляла собой зрелую фиброзную ткань в виде тонкой полоски (рис. 3).
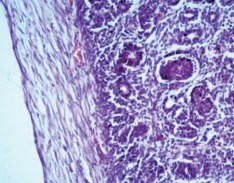
Рис. 3. Почка стентированная. Стенка раневого канала: зрелая фиброзная ткань в виде тонкой полоски. Окраска гематоксилином и эозином. Ув.х200
В фиброзной ткани определялась незначительная очаговая инфильтрация полиморфными лейкоцитами, в которой преобладали лим- фоциты и плазматические клетки, были обнаружены единичные нейтрофильные гранулоциты (рис. 4).
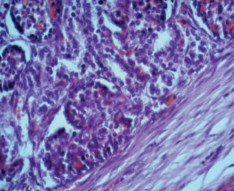
Рис. 4. Почка стентированная. Незначительная очаговая инфильтрация полиморфными лейкоцитами в фиброзной стенке раневого канала. Окраска гематоксилином и эозином. Ув.х400
В фиброзной ткани оказались замурованы несколько прямых канальцев со щелевидными просветами и сохраненным светлым эпителием (рис. 5).
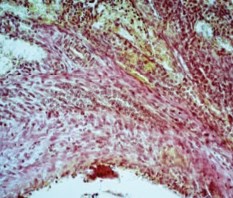
Рис. 5. Почка стентированная. Участок фиброзной стенки раневого канала с замурованными несколькими прямыми канальцами со щелевидными просветами. Окраска пикрофуксином по ванн Гизону. Ув.х400
В корковом слое прилежат к фиброзной стенке единичные модифицированные почечные тельца с гиперплазированными клубками капилляров, некоторые петли капилляров с толстой стенкой (рис. 6).
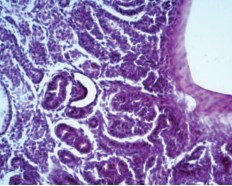
Рис. 6. Почка стентированная. Модифицированные почечные тельца с гиперплазированными клубками капилляров. Окраска гематоксилином и эозином. Ув.х200
Вокруг стенки раневого канала отмечена компенсаторная пролиферация и гиперплазия почечных телец и извитых канальцев, которые распространялись вдоль длительно стоящего стента в пирамиду, тем самым нарушая гистоархитектонику слоев почки (рис. 7).
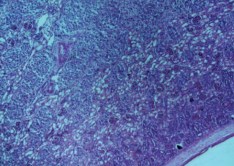

Рис. 7. Почка стентированная. Дифференцированные корковый и мозговой слои. Компенсаторная пролиферация и гиперплазия почечных телец и извитых канальцев вокруг стенки раневого канала в мозговом слое. Окраска гематоксилином и эозином. Ув.х40
В целом строение нефрона стентированной почки не отличалось от такового в группе сравнения (рис. 8).
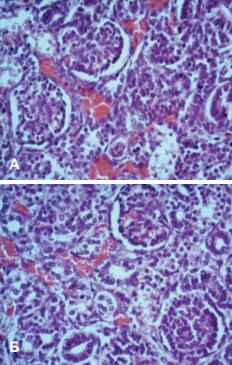
Рис. 8. Корковый слой: А.почка группы сравнения; Б.почка стентированная. Окраска гематоксилином и эозином. Ув.х400
Проведенная морфометрия структурных элементов сравниваемых групп почек не выявила значимых отличий (табл. 2).
Таблица 2. Морфометрические показатели структурных элементов стентированных и нестентированных почек (%,М±m)
| Показатель | Клубочки | Сосуды | Извитые канальцы | Прямые и выводные канальцы, петля Генле | Строма | Фиброз | Раневой канал | Лейкоцитарная инфильтрация |
|---|---|---|---|---|---|---|---|---|
| Шунтированные почки | 15,58±1,59* | 10,56±1,24* | 44,69±2,87* | 11,02±1,25* | 14,41±2,07* | 0,95±0,09 | 2,58±0,2,02 | 0,18±0,07 |
| Нестентированные почки | 15,80±2,08 | 47,24±2,54 | 10,69±1,60 | 11,24±0,81 | 5,01±2,17 | 0 | 0 | 0 |
*нет значимых отличий при р≥0,05
В стентированных почках фиброзная стенка раневого канала в паренхиме занимает 0,95±0,09%. Лейкоцитарный инфильтрат в стенке раневого канала составил всего 0,18± 0,07% от всей паренхимы почки. Доля просвета раневого канала была 2,58±0,02%.
ОБСУЖДЕНИЕ
При селективном ультразвуковом скрининге беременных группы риска частота врожденных пороков развития мочевыводящей системы составляет в среднем 34:1000 беременностей. Около 1% новорожденных имеют пренатально диагностированный гидронефроз или значительную дилатацию почечных лоханок. В случае нарастания пиелоэктазии, сопровождающейся уменьшением паренхимы почки, необходимо срочное полное нефро-урологическое обследование для определения дальнейшей тактики лечения, в том числе оперативного [9-13].
При обнаружении тяжелых форм врожденных пороков развития органов мочевыводящей системы с семьей обсуждается вопрос прерывания беременности в сроки до 22 нед. Результаты исследований показывают, что именно в пери- и неонатальном периодах формируются предпосылки для развития хронических заболеваний почек и дистальных отделов мочевыводящей системы у детей раннего и старшего возраста.
В современных условиях владея методами пренатальной коррекции обструктивных поражений мочевыделительной системы, мы можем добиться улучшения перинатальных исходов при тяжелых двусторонних и односторонних поражениях мочевыделительной системы [4, 14-17].
В связи с тем, что инфравезикальная обструкция связана с увеличением перинатальной и младенческой смертности и заболеваемости, были предложены дородовые мероприятия для предотвращения осложнений со стороны мочевыделительной системы у новорожденных. Оптимальное лечение данной патологии продолжает быть одним из самых сложных вопросов в фетальной терапии.
Наиболее часто применялся метод везикоамниального шунтирования при заднеуретральных клапанах у плодов мужского пола, о чем впервые сообщили M.S. Golbus и соавт.в 1982 году [8]. С этого времени эффективность пренатальной терапии в улучшении функции почек и задержке прогрессирования хронической терминальной стадии почечной недостаточности до сих пор не доказана окончательно. Мы проанализировали последние публикации и систематический обзор R.K. Morris, R. Ruano, M.D. Kilby. Все авторы отмечают повышение выживаемости младенцев с инфравезикальной обструкцией после применения внутриутробных лечебных мероприятий, но долгосрочная детская заболеваемость остается на прежнем уровне, а может и ухудшаться [14, 19,20].
Внутриутробная цистоскопия у плода проводилась в качестве альтернативного лечения инфравезикальной обструкции. Данный вид лечения имеет теоретические преимущества над везикоамниальным шунтированием, так как уточняет диагноз и проводится абляция заднеуретральных клапанов. Однако, если выявляется атрезия уретры, операция не может быть выполнена и данная пренатальная терапия невозможна [19,21]. Небольшое количество исследователей изучили эту технику с точки зрения диагностической процедуры, поскольку УЗИ имеет относительно низкую способность дифференцировать причины обструктивной уропатии. A. Welsh и соавт. предложил цистоскопию плода в качестве диагностики атрезии уретры [21]. R.K. Morris и соавт. в своем обзоре указывают, что чувствительность цистоскопии в диагностике атрезии уретры была между 87,5 и 100%, специфичность — 85,7%.
[14], предыдущие исследования R. Robyr и соавт. показали, низкую (45%) чувствительность ультразвука
[15]. Цистоскопия, как пренатальная терапия обструкции нижних мочевыводящих путей плода, не снижает перинатальную смертность и заболеваемость по сравнению с везикоамниальным шунтированием [14].
Очень мало опубликованных сведений об эффективности цистоскопии у плода в качестве диагностического и терапевтического вмешательства при интравезикальной обструкции. Применение везикоамниального шунтирования проводится чаще, но данные так же противоречивы.
В литературе нет данных исследований по применению шунтирующих операций почек плода. В наших исследованиях мы показали перспективность этих манипуляций. Они не только купируют проявления инфравезикальной обструкции, но и применимы при гидронефрозах III-IV степени у подов, что профилактирует развитие вторично сморщенных почек.
Ранняя пренатальная диагностика и своевременно начатое внутриутробное и постнатальное хирургическое лечение позволяют в большинстве случаев предотвратить развитие осложнений и неблагоприятный исход заболеваний органов мочевой системы у новорожденных детей.
В ФГБУ «НИИ ОММ» МЗ РФ разработана малоинвазивная методика шунтирования почек плода. Наиболее частым неблагоприятным исходом проводимых нами шунтирующих операций почек стентами других производителей была экспульсия стента-эндопротеза. Мы разработали почечно-амниальный стент для внутриутробного применения, проведена его апробация на экспериментальных животных и выпадения этих стентов из почек плодов овец не регистрировалось [22-25]. Было показано, что фиброзная ткань вокруг инородного тела (стента) занимала минимальный объем и расценена как исход асептического воспалительного процесса в паренхиме почки плода. Зона изменений почечной паренхимы была незначительной. Морфометрически подтверждено, что внутриутробное развитие шунтированной почки не отличается от контрлатеральной.
ВЫВОДЫ
Для определения доли патологического процесса была применена методика морфометрии, позволяющая более детально оценить изменения в почечной паренхиме при длительном стоянии стента у плодов овец.
Морфометрическая картина почек плодов экспериментальных животных после их внутриутробного шунтирования доказывает безопасность использования разработанного отечественного почечно-амниального стента. Стент, разработанный в НИИ ОММ, при длительном стоянии не вызывает значимого повреждения ткани почек и перестройки паренхимы, не оказывает отрицательного влияния на развитие нефрона.
ЛИТЕРАТУРА
1. Айламазян Э.К., Баранов В. С. Пренатальная диагностика наследственных и врожденных болезней. М.: МЕДпресс-информ, 2006, 416 с.
2. Молчанова Е. А, Валов А. Л, Каабак М. М. Первые результаты формирования Российского регистра хронической почечной недостаточности у детей. Нефрология и диализ 2003;5(1): 64-68.
3. Bernstein J. Developmental abnormalities of the renal parenchyma-renal hypoplasia and dysplasia.
Pathol Annu 1958;3:213-247.
4. Glick PL, Harrison MR, Adzick NS, Noall RA, Villa RL. Correction of congenital hydronephrosis in utero IV: in utero decompression prevents renal dysplasia. J Pediatr Surg 1984;19(6):649-57.
5. Diamond JR, van Goor H, Ding G, Engelmyer E. Myofibroblasts in experimental hydronephrosis. Am J Pathol 1995;146(1):121-129.
6. Pluto Collaborative Study Group, Kilby M, Khan K, Morris K, Daniels J, Gray R, Magill L, Martin B, et al. PLUTO trial protocol: percutaneous shunting for lower urinary tract obstruction randomized controlled trial. BJOG 2007;114(7):904-5, e1-4.
7. Волкова О.В., Елецкий Ю.К. Основы гистологии с гистологической техникой, 2-е изд. М.: Медицина, 1982, 304 с.
8. Автандилов Г.Г. Медицинская морфометрия. М.: Медицина, 1992, 36 c.
9. Kumar M, Gupta U, Thakur S, Aggrawal S, Meena J, Sharma S, et al. Prenatal sonographic evaluation and postnatal outcome of renal anomalies. Indian J Hum Genet 2012;18(1):75-82
10. Chapin HC, Caplan MJ. The cell biology of polycystic kidney disease. J Cell Biol 2010;191(4);701-10. doi: 10. 1083/j cb.201006173.
11. Call KM1, Glaser T, Ito CY, Buckler AJ, Pelletier J, Haber DA, et al. Isolation and characterization of a zinc finger polypeptide gene at the human chromosome Wilms' tumor locus. Cell 1990;60(3):509-20
12. Sharma PM, Yang X, Bowman M, Roberts V, Sukumar S. Molecular cloning of rat Wilms' tumor complementary DNA and a study of messenger RNA expression in the urogenital system and the brain.
Cancer Res 1992;52(22):6407-12
13. Israel GM, Bosniak MA. How I do it: evaluating renal masses. Radiology 2005;236(2);441-50
14. Morris RK, Ruano R, Kilby MD. Effectiveness of fetal cystoscopy as a diagnostic and therapeutic intervention for lower urinary tract obstruction: a systematic review. Ultrasound Obstet Gynecol 2011;37(6):629-37. doi: 10.1002/uog.8981.
15. Robyr R, Benachi A, Daikha-Dahmane F, Martinovich J, Dumez Y, Ville Y. Correlation between ultrasound and anatomical findings in fetuses with lower urinary tract obstruction in the first half of pregnancy. Ultrasound Obstet Gynecol 2005;255(5):478 — 482.
16. Morris R, Kilby M. The PLUTO trial: percutaneous shunting in lower urinary tract obstruction. AJOG 2012;206(1, Suppl.):14.
17. Won HS, Kim SK, Shim JY, Lee PR, Kim A. Vesicoamniotic shunting using a double-basket catheter appears effective in treating fetal bladder outlet obstruction. Acta Obstet Gynecol Scand 2006;85:879-884
18. Golbus MS, Harrison MR, Filly RA, Callen PW, Katz M. In utero treatment of urinary tract obstruction . AJOG 1982;142:383- 388.
19. Ruano R, Yoshizaki CT, Giron AM, Srougi M, Zugaib M. Cystoscopic placement of transurethral stent in a fetus with urethral stenosis. Ultrasound Obstet Gynecol 2014;44:238- 240.
20. Bernardes LS, Aksnes G, Saada J, Masse V, Elie C, Dumez Y, et al. Keyhole sign: how specific is it for the diagnosis of posterior urethral valves? Ultrasound Obstet Gynecol 2009;34(45):419-423.
21. Welsh A, Agarwal S, Kumar S, Smith RP, Fisk NM. Fetal cystoscopy in the management of fetalob-structive uropathy: experience in a single European centre. Prenat Diagn 2003;23(13): 1033-104
22. Косовцова Н.В., Маркова Т.В., Ковалев В.В., Потапов Н.Н. Случай внутриутробной коррекции инфравезикальной обструкции. Уральский медицинский журнал (перинатология) 2012;103(11): 36-38.
23. Косовцова Н.В. Внутриутробные хирургические вмешательства под контролем УЗИ — уже не фантастика. Медицина Урала 2011;(3):14-16
24. Косовцова Н.В., Башмакова Н.В., Павличенко М.В., Маркова Т.В. Новый взгляд на лечение обструктивных уропатий у плода. Вопросы гинекологии, акушерства и перинатологии 2015;14(3):33-38.
25. Kosovtsova N.V., Bashmakova N.V., Pavlichenko M.V., Markova T.V. Outcome of prenatal interventions for fetal lower urinary tract obstruction. Наука и мир 2015;1(9):109-112.









Комментарии