Журнал "Экспериментальная и клиническая урология" Выпуск №1 за 2015 год
Сивков А.В., Кешишев Н.Г., Кривенко М.П., Ковченко Г.А., Рабинович Э.З., Никонова Л.М., Ромих Ф.Д.
Хромогранин (Хг) представляет собой кислый гликопротеин, состоящий из 439 аминокислот. Данный гликопротеин присутствует в ядрах большинства нейроэндокринных клеток [1]. Семейство хромогранинов состоит из трех различных водорастворимых кислых гликопротеинов – хромогранин А (ХгА), хромогранин B (ХгB), секретогранин II или хромогранин C (ХгС). По всей длине молекулы Хг распределены основные аминокислотные остатки, особенно ими богат С-конец молекулы. По этим аминокислотным остаткам происходит расщепление молекулы, в результате чего образуются вазостатин и хромостатин. ХгВ сходен по химической структуре с ХгА, но распространен менее широко [2, 3].
ХгА широко используется в качестве иммуногистохимического маркера нейроэндокринной дифференцировки (НЭД). При наличии стимулирующих факторов происходит высвобождение ХгА, других пептидных гормонов и нейропептидов. В панели маркеров НЭД ХгА обладает наибольшей диагностической ценностью.
ХгА экспрессируется опухолями, имеющими нейроэндокринное происхождение, из различных эмбриональных отделов первичной кишки – верхнего (foregut), из которого дифференцируются бронхи, легкие, желудок, проксимальный отдел двенадцатиперстной кишки, поджелудочная железа; среднего (midgut), предшественника дистального отдела двенадцатиперстной кишки, тощей, подвздошной, слепой и восходящей ободочной кишки, а также аппендикса; нижнего (hindgut), из которого развиваются дистальные отделы толстой кишки и прямая кишка [4, 5].
ХгА может повышаться при гастро-энтеро-панкреатических опухолях, нейроэндокринных опухолях (НЭО) поджелудочной железы, синдроме множественной эндокринной неоплазии 1 типа, опухолях мозгового слоя надпочечников, опухоли паращитовидных желез, феохромоцитомах, нейробластомах, некоторых гипофизарных опухолях и др. [6].
Специфичность ХгА в диагностике НЭО зависит от природы и локализации образования, в некоторых случаях она достигает 100%, например, при метастатическом раке истинно нейроэндокринных опухолей [7, 8, 9, 10].
В соответствии с рекомендациями Европейского общества по нейроэндокринным опухолям ХгА является обязательным маркером биохимического обследования для диагностики, мониторинга и прогноза НЭО [11]. ХгА характеризуется высокой диагностической чувствительностью при НЭО желудка (95%), подвздошной кишки (80%), бронхолегочной системы (70%), синдроме множественных эндокринных неоплазий (78%). При этом, в различных исследованиях была выявлена зависимость ХгА от распространенности процесса [4].
Среди факторов, вызывающих ложноположительное повышение ХгА крови, можно выделить:
- нарушение функции почек [12, 13];
- болезнь Паркинсона, нелеченная гипертензия и беременность;
- лечение гормонами, в том числе глюкокортикоидами [14, 15];
- хронический атрофический гастрит типа А [16];
- лечение ингибиторами протонной помпы или блокаторами Н2рецепторов [17].
Чувствительность и специфичность определения плазматических уровней ХгА при различных нейроэндокринных заболеваниях варьирует от 70% до 95%. Наиболее высокие показатели ХгА наблюдают в случае опухолей с выраженной секреторной активностью [18].
Не существует единого международного стандартизированного подхода к определению ХгА. Коммерческие наборы для определения ХгА отличаются типом используемых антител (моноклональное и поликлональные), а также методом анализа (иммуноферментный и радиоиммунный). Подобные различия в методах неизбежно приводят к неоднородности результатов [19, 20].
В России официально зарегистрированы две тест-системы определения ХгА: тест-система компании DAKO (Дания) и компании Euro-Diagnostica (ED Швеция).
Оба метода проводятся путем иммуноферментного анализа, представляют собой количественное определение ХгА крови. В наборах DAKO и ED используются плазма крови (сыворотка крови), этилендиаминтетрауксусная кислота (ЭДТА) или гепариновая плазма. Для определения ХгА в наборах ED и DAKO применяются разные единицы измерения: нмоль/л и Ед/л соответственно. Согласно данным компаний производителей референсные значения для ED и DAKO составляют 0-3 нмоль/л и 2-18 Ед/л соответственно [21, 22].
Референсные значения для ED рассчитывались на основе 97,5 процентиля для образцов, собранных у 120 доноров крови (60 мужчин и 60 женщин в возрасте 20-65 лет). Ожидаемый диапазон референсных значений ХгА составил 0-3 нмоль/л. Расчеты были выполнены в соответствии с правилами Consensus Standards for Medical Testing: NCCLS EP17 – A [23]. К сожалению, мы не смогли получить данные о методиках расчета референсных диапазонов для ХгА компании DAKO.
В урологии ХгА применяется для определения НЭД, главным образом, при раке предстательной железы (РПЖ). Повышенные значения данного маркера могут свидетельствовать о присутствии нейроэндокринных клеток в ткани ПЖ [24, 25]. Обнаружение НЭД диктует необходимость назначения патогенетической терапии, включая аналоги соматостатина [26]. В ходе наших предыдущих исследований возникла проблема интерпретации (согласования) значений ХгА, определенных разными тест-системами, что вело к диагностическим ошибкам. [27]. Поэтому, целью нашей работы стало сравнение показателей ХгА, определенных тест-системами DAKO и ED при различных заболеваниях предстательной железы.
МАТЕРИАЛЫ И МЕТОДЫ
Всего в исследование было включено 304 мужчин с доброкачественной гиперплазией предстательной железы (ДГПЖ), хроническим простатитом, простатической интраэпителиальной неоплазией (ПИН) низкой степени, ПИН высокой степени, локализованным РПЖ (ЛРПЖ), местнорапрострененным РПЖ (МРРПЖ), кастрационно-резистентным РПЖ (КРРПЖ). Также была набрана контрольная группа здоровых мужчин. У 113 пациентов мы смогли определить ХгА двумя тест-системами. Кроме того, всем пациентам были выполнены клинический и биохимический анализы крови для выявления сопутствующих патологических процессов, а также определен уровень простатспецифического антигена (ПСА) сыворотки крови. С учетом анамнеза у пациентов исключали заболевания желудочно-кишечного тракта, эндокринной системы, онкологические процессы, неконтролируемую артериальную гипертензию, предшествующие хирургические манипуляции на органах мочевой системы. При обнаружении указанных заболеваний пациенты в исследование не включались.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По результатам исследования мы получили явно завышенные показатели при различных заболеваниях ПЖ при использовании тестсистемы DAKO по сравнению с ED (табл. 1).
В группе больных, где уровень ХгА определялся с помощью ED, повышенный ХгА (ХгА≥ 3 нмоль/л) был выявлен у 5 пациентов КРРПЖ и у 1 – с ЛРПЖ, тогда как в группе, где использовалась тест-система DAKO превышение верхней границы нормы (18 Ед/л) было определено 34 пациента, в том числе у 6 мужчин контрольной группы.
С чем связанно такое несоответствие? Первый возможный ответ – это погрешности технологий определения ХгА. Второй причиной может быть несоответствие референсных значений той или иной тест-системы. Таким образом, мы столкнулись со сложностями интерпретации значений сывороточного ХгА, определенного тест-системами DAKO и Euro-Diagnostica.
Таблица 1. Число больных с повышенным уровнем ХгА, определенного тест-системами DAKO и Euro-Diagnostica при заболеваниях предстательной железы
| Заболевание | n | Превышение референсных значений | |
|---|---|---|---|
| ED: >3 нмоль/л | DAKO: >18 Ед/л | ||
| Контрольная группа |
29 |
0 | 6 |
| ДГПЖ |
3 |
0 | 0 |
| Хронический простатит |
8 |
0 | 1 |
| ПИН низкой степени |
9 |
0 | 1 |
| ПИН высокой степени |
5 |
0 | 1 |
| ЛРПЖ |
24 |
1 | 9 |
| МРРПЖ |
7 |
0 | 3 |
| КРРПЖ |
28 |
5 | 13 |
| ВСЕГО пациентов | 113 | ||
Для определения диагностической ценности двух тест-систем нами был проведен сравнительный многофакторный математический анализ показателей ХгА при различных заболеваниях ПЖ. Были приняты следующие обозначения: ХгА D – для измерений в тест-системе компании DAKO, ХгА E – для EuroDiagnostica. Все пациенты были разделены на следующие группы: контрольную, в которую вошли здоровые мужчины и еще 7 групп с различными заболеваниями ПЖ. Всего были проанализированы данные 113 мужчин, из которых 29 – составили контрольную группу.
С целью формирования статистических моделей для имеющихся данных был проведен их предварительный анализ. В первую очередь это касалось контрольной группы, которую можно рассматривать как однородную совокупность наблюдений. В таблице 2 представлены оценки первых моментов (среднего μ и стандарта σ) и коэффициента вариации σ/μ, а также результаты проверки гипотезы о том, что для имеющихся данных применимо нормальное распределение. В последнем случае использовались критерий асимметрии (равенство нулю нормированного 3-го центрального момента) и критерий эксцесса (равенство определенному значению нормированного 4-го центрального момента) и 1% значение уровня значимости.
Из этого можно сделать вывод о том, что:
1. Измерения маркеров XгA E и XгA D осуществляются в пропорциональных единицах (похожие значения коэффициента вариации σ/μ), т.е. ни одно из этих измерений не имеет явных преимуществ с точки зрения точности.
2. Для измерений XгA E и XгA D нет предпосылок принять гипотезу о нормальном распределении, поэтому требуется осторожность при использовании методов, ориентированных на эту модель данных.
Несмотря на то, что в обеих тест-системах анализируется одна и та же характеристика, сомнения относительно согласованности формируемых измерений привели к желанию исследовать статистическую зависимость значений ХгА. В соответствии со сделанным замечанием об осторожности использования нормального распределения для исследования зависимости использовался критерий хи-квадрат для таблицы сопряженности 5x5 [26]. Получившиеся статистические значения приведены в таблице 3, где для 1% уровня значимости указан результат принятия гипотезы о независимости измерений XгA E и XгA D.
Из данной таблицы следует, что между маркерами XгA E и XгA D есть ярко выраженная связь и она не маскируется ошибками измерений. Интересно, что аналогичный анализ для ПСА и XгA E, а также для ПСА и XгA D показал, что гипотеза о независимости может быть принята (табл. 3), что свидетельствует о том, что XгA E и XгA D являются иными, специфическими характеристиками процессов, протекающих в организме пациентов, нежели чем ПСА.
Таблица 2. Статистический анализ (μ, σ, σ/μ) значений ХгА мужчин контрольной группы
| Маркер | μ | σ |
σ/μ |
Гипотеза о нормальности распределения | |
|---|---|---|---|---|---|
| Критерий асимметрии | Критерий эксцесса | ||||
| XгA E | 1,31 |
0,59 |
45% |
Отвергается | Принимается |
| XгA D | 14,70 | 7,12 | 48% | Отвергается | Отвергается |
Таблица 3. Статистическая зависимость значений ХгА (DAKO и Euro-Diagnostica) и ПСА
| Пара маркеров |
χ2 16 |
Гипотеза о независимости |
|---|---|---|
| XгA E, ПСА |
21,90 |
Принимается |
| XгA D, ПСА |
21,30 |
Принимается |
| XгA E, XгA D | 125,67 | Отвергается |
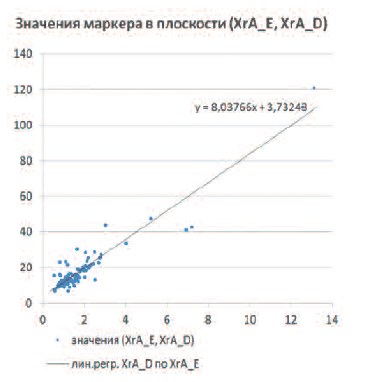
Рис. 1. Линейная зависимость значений XrA (DAKO и Euro-Diagnostica)
Для нашего исследования более важным, чем установление наличия зависимости, является описание закона этой зависимости. Визуальный анализ рисунка 1 позволяет выдвинуть предположение о том, что связь значений измерений маркеров, как для контрольной группы, так и в остальных случаях можно описать как линейную.
Таким образом, приходим к задаче линейного регрессионного анализа [28], решение которой дает следующую модель зависимости:
XгA D=3,73243 + 8,03766•XгA E + εD. (уравнение 1).
Понятно, что совершенно аналогично можно построить регрессию XгA E по XгA D, а именно:
XгA E= – 0,25827 + 0,11287•XгA D + εE. (уравнение 2).
Оценки для квадратичного отклонения ошибки ε принимают соответственно значения 4,66641 для εD и 0,55298 для εE. О степени адекватности построенных регрессионных моделей можно судить по значению так называемого коэффициента детерминации R2 – доли дисперсии прогнозируемой переменной (например, в уравнении 1 – это ХгА D), объясняемой рассматриваемой моделью зависимости (в уравнении 1 – это формула 3,73243+8,03766•ХгА E). Значения R2 обычно представляются в процентах и считается, что для подходящих, хорошо подобранных моделей R2 >50%. Оценка R2 строится с помощью выборочной дисперсии прогнозируемой переменной (в уравнении 1 – это ХгА D) и выборочной дисперсии ошибки представления (в уравнении 1 – это оценка дисперсии εD). При анализе зависимости результатов измерений различными тест-системами получаем значение R2=91%, что говорит о приемлемости выбранной модели линейной зависимости. Заметим, что для рассматриваемой линейной регрессии коэффициент детерминации равен квадрату обычного коэффициента корреляции ρ для ХгА E и ХгА D, т.е. ϱ=√R2=0.95.
Воспользуемся установленной связью между двумя способами измерения ХгА и согласуем результаты по референсным значениям. Имеющаяся контрольная выборка позволяет оценить процентили распределения значений маркера. Соответствующие значения даны в таблице 4.
Строки таблицы привязаны к элементам вариационного ряда для контрольной выборки, по этой причине значения процентов не кратны 10 и имеют не совсем привычный вид. Значение ХгА E =2,99 для 97% (в последней строке таблицы) не противоречит референсным значениям 0-3, поэтому может быть принято за базовое.
Таблица 4. Пороговые значения ХгА для тест-систем DAKO и Euro-Diagnostica
| Частота правильного диагностирования «здоровых» |
Пороговое значение для XгA E |
Пороговое значение для XгA D |
|---|---|---|
| 41% |
1,03 |
12,60 |
| 52% |
1,18 |
12,94 |
| 59% |
1,20 |
13,20 |
| 69% |
1,40 |
14,49 |
| 79% |
1,86 |
18,20 |
| 90% |
2,48 |
22,85 |
| 97% | 2,99 | 44,00 |
Таблица 5. Число больных с повышенным уровнем ХгА, определенного тест-системами DAKO и Euro-Diagnostica согласно регламентным и согласованным значениям
| Заболевание | n |
Регламентные референсные значения | Согласованные референсные значения |
|
|---|---|---|---|---|
| ED: >3 нмоль/л | DAKO: >18 Ед/л | DAKO: >28 Ед/л | ||
| Контрольная группа |
29 |
0 |
6 |
2 |
| ДГПЖ |
3 |
0 |
0 |
0 |
| Хронический простатит |
8 |
0 |
1 |
0 |
| ПИН низкой степени |
9 |
0 |
1 |
0 |
| ПИН высокой степени |
5 |
0 |
1 |
0 |
| ЛРПЖ |
24 |
1 |
9 |
3 |
| МРРПЖ |
7 |
0 |
3 |
0 |
| КРРПЖ |
28 |
5 |
13 |
5 |
| ВСЕГО пациентов | 113 | 6 | 34 | 10 |
На основании соотношений в уравнениях 1 и 2 получаем, что средние значения ХгА D и ХгА E при заданных параметрах ХгА E и ХгА D можно вычислить по следующим формулам:
XгA D=3,73243 + 8,03766•XгA E, ХгA E= – 0,25827 + 0,11287•XrA D, из которых видно, что значению ХгA E=3,00 соответствует ХгА D=27.84≈28, а не регламентированное значение 18. Обратно, если бы мы взяли ХгА D=18, то должны были получить ХгA E=1,77.
При согласовании референсных значений (0-3 нмоль/л – для ХгA E и 0-28 Ед/л – для ХгA D) получаем данные, представленные в таблице 5.
Сравнение пары столбцов (ED: 0-3) и (DAKO:2-18) с парой (ED:0-3) и (DAKO:0-28) в этой таблице показывает, что несогласованность значений ХгА, определенных с помощью тест-систем DAKO и EuroDiagnostica, практически исчезла.
ВЫВОДЫ
Исходя из полученных данных, следует отметить:
- Официальное референсное значение верхнего уровня ХгА, заявленное DAKO, недостаточно точно и ведет к гипердиагностике НЭД при заболеваниях предстательной железы. Это в определенной мере объясняет противоречивость литературных данных о частоте повышения ХгА уровня крови у больных РПЖ.
- Математически-скорректированный показатель верхней границы ХгА при использовании тест-системы DAKO равен 28 Ед/л.
- Выявленная зависимость позволит улучшить диагностику НЭД РПЖ и скорректировать результаты исследований, полученных ранее при использовании тест-системы DAKO.
ЛИТЕРАТУРА
- Deftos LJ. Chromogranin A: its role in endocrine function and as an endocrine and neuroendocrine tumor marker. // Endocr Rev. 1991. Vol. 12, N 2. P. 181–187.
- Abrahamsson PA. Neuroendocrine differentiation in prostatic carcinoma. // Prostate. 1999. Vol. 39, N 2. P. 135-148.
- Angelsen A, Syversen U, Haugen OA, Stridsberg M, Mjølnerød OK, Waldum HL. Neuroendocrine differentiation in carcinomas of the prostate: do neuroendocrine serum markers reflect immunohistochemical findings? // Prostate. 1997. Vol. 30, N 1. P. 1-6.
- Любимова Н.В., Костылева О.И., Маркович А.А. Биохимические маркеры нейроэндокринных опухолей: методические и клинические аспекты. // URL: http://www.cyto.ru/index.php/shkola-tsitologa/33-publikatsii/409-biokhimicheskie-markerynejroendokrinnykhopukholej-metodicheskie-i-klinicheskie-aspekty.
- Rindi G, Kloppel G. Endocrine tumors of the gut and pancreas tumor biology and classification. // Neuroendocrinology. 2004. Vol. 80, Suppl. 1. P. 12–15.
- Peracchi M, Conte D, Gebbia C, Penati C, Pizzinelli S, Arosio M, Corbetta S, Spada A. Plasma chromogranin A in patients with sporadic gastro-entero-pancreatic neuroendocrine tumors or multiple endocrine neoplasia type 1. // Eur J Endocrinol. 2003. Vol. 148, N 1. P. 39-43.
- Eriksson B., Arnberg H., Oberg K., Hellman U., Lundqvist G., Wernstedt C, Wilander E. A polyclonal antiserum against chromogranin A and B – a new sensitive marker for neuroendocrine tumours. // Acta Endocrinol (Copenh). 1990. Vol. 122, N 2. P. 145–155.
- O’Connor DT, Pandlan MR, Carlton E, Cervenka JH, Hslao RJ. Rapid radioimmunoassay of circulating chromogranin A: in vitro stability, exploration of the neuroendocrine character of neoplasia, and assessment of the effects of organ failure. // Clin Chem. 1989. Vol. 35, N 8. P. 1631–1637.
- Sobol RE, Memoli V, Deftos LJ. Hormonenegative, chromogranin A-positive endocrine tumors. // N Engl J Med. 1989. Vol. 320, N 7. P. 444–447.
- Zatelli MC, Torta M, Leon A, Ambrosio MR, Gion M, Tomassetti P, De Braud F, Delle Fave G, Dogliotti L, degli Uberti EC. Chromogranin A as a marker of neuroendocrine neoplasia: an Italian Multicenter Study. // Endocr Relat Cancer. 2007. Vol. 14, N 2. P. 473–482.
- O'Toole D., Grossman A., Gross D., Delle Fave G., Barkmanova J., O'Connor J, Pape UF, Plöckinger U. ; ENETS Consensus Guidelines for the Standards of Care in Neuroendocrine Tumors: biochemical markers. // Neuroendocrinology. 2009. Vol. 90, N 2. P. 194–202.
- Hsiao RJ, Mezger MS, O’Connor DT. Chromogranin A in uremia: progressive retention of immunoreactive fragments. // Kidney Int. 1990. Vol. 37, N 3. P. 955–964.
- Stridsberg M, Oberg K, Li Q, Engstrom U, Lundqvist G. Measurements of chromogranin A, chromogranin B (secretogranin I), chromogranin C (secretogranin II) and pancreastatin in plasma and urine from patients with carcinoid tumours and endocrine pancreatic tumours. // J Endocrinol. 1995. Vol. 144, N 1. P. 49–59.
- Giovanella L, La Rosa S, Ceriani L, Uccella S, Erba P, Garancini S. Chromogranin-A as aserum marker for neuroendocrine tumors: comparison with neuron-specific enolase and correlation with immunohistochemical findings. // Int J Biol Markers. 1999. Vol. 14, N 3. P. 160–166.
- Rozansky DJ, Wu H, Tang K, Parmer RJ, O’Connor DT. Glucocorticoid activation of chromogranin A gene expression. Identification and characterization of a novel glucocorticoid response element. // J Clin Invest. 1994. Vol. 94, N 6. P. 2357–2368.
- O’Toole D. Current trend: endocrine tumors of the stomach, small bowel, colon and rectum. // Gastroenterol Clin Biol. 2006. Vol. 30, N 2. P. 276–291.
- Sanduleanu S, De Bruine A, Stridsberg M, Jonkers D, Biemond I, Hameeteman W, Lundqvist G, Stockbrügger RW. Serum chromogranin A as a screening test for gastric enterochromaffin-like cell hyperplasia during acid-suppressive therapy. // Eur J Clin Invest. 2001. Vol. 31, N 9. P. 802–811.
- Prestifilippo A, Giusi P, Vilate MP, Giuffrida D. Chromogranin A and Neuroendocrine Tumors // In book: Neuroendocrine Tumor. [Anthony Lowell eds]. 2012. P. 11-17.
- O’Connor DT, De Thos LJ. Secretion of chromogranin A by peptide-producing endocrine neoplasms. // N Engl J Med. 1986. Vol. 314, N 18. P. 1145–1151.
- Stridsberg M, Husebye ES. Chromogranin A and chromogranin B are sensitive circulating markers for phaeochromocytoma. // Eur J Endocrinol. 1997. Vol. 136, N 1. P. 67–73.
- Chromogranin A reliable marker in the diagnosis and follow up of neuroendocrine tumors (NET). // RRL: http: // www.daco.come/chromogranin_a_-brochure-29006-01dec2011_print__highres.pdf
- Human Chromogranin A ELISA Kit. // URL: www.biochemmack.ru
- Tolen DW, Linnet K, Kondratovich M, Armbruster DA, Garrett PE, Jones RL, Kroll MH, LequinRM, Pankratz TJ, Scassellati GA, Schimmel H, Jane Tsai J. Protocols for Determination of Limits of Detection and Limits of Quantitation; Approved Guideline. EP17-A. Vol. 24, N 34. 52 p.
- Abrahamsson PA, Falkmer S, Fält K, Grimelius L. The course of neuroendocrine differentiation in prostatic carcinomas. An immunohistochemical study testing chromogranin A as an "endocrine marker". // Pathol Res Pract. 1989. Vol. 185, N 3. P. 373-380.
- Khan MO, Ather MH. Chromogranin A – serum marker for prostate cancer. // J Pak Med Assoc. 2011. Vol. 61, N 1. P. 108-111.
- Sciarra A, Innocenzi M, Ravaziol M, Minisola F, Alfarone A, Cattarino S, Cattarino S, Monti G, Gentile V, Di Silverio F. Neuroendocrine target therapies for prostate cancer. // Urologia. 2011. Vol. 78, N 2. P. 137-141.
- Аполихин О.И., Сивков А.В., Ефремов Г.Д., Рабинович Э.З., Кешишев Н.Г., Ковченко Г.А., Проъоров С.А., Соков Д.Г., Никонова Л.М., Кривенко М.П. Показатели хромогранина А сыворотки крови при различных заболеваниях предстательной железы. // Экспериментальная и клиническая урология. 2014. N 1. С. 25-30.
- Справочник по прикладной статистике. В 2-х томах [Под ред. Ллойда Э., Ледермана У., Тюрина Ю.Н.]. М.: Финансы и статистика. – 1989.









Комментарии