Синельников Л.М., Протощак В.В., Шестаев А.Ю., Карпущенко Е.Г., Янцев А.А.
Cогласно определению Международного урологического консилиума ведущих экспертов Интернационального общества урологов (SIU/ICUD, 2014 г.) под стриктурой уретры понимают патологическое сужение любой части мочеиспускательного канала, окруженного спонгиозным телом, в результате развития спонгиофиброза [1]. В нашей стране наиболее цитируемым является определение М.И. Когана: стриктура уретры – полиэтиологическое обструктивное поражение уретры, сопровождающееся симптомами со стороны нижних мочевых путей [2]. В последнее время в связи с особенностями патогенеза и склонностью этого заболевания к рецидивирующему течению, многие авторы в качестве определения используют термин стриктурная болезнь, который считается равноправным наряду со стриктурой уретры.
Стриктура уретры является распространенной и сложной урологической патологией. Заболеваемость в последние десятилетия неуклонно растет, варьирует от 0,6% до 0,9% в популяции и зависит от возрастного состава пациентов (рис. 1). При этом протяженные и субтотальные поражения диагностируются в 15-18% случаев стриктурной болезни уретры [3-5].
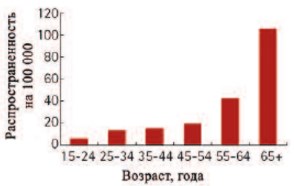
Рис. 1. Зависимость распространенности стриктуры уретры от возраста [6]
По данным исследования R. Santucci и соавт. в США около 1 500 000 пациентов в год обращаются в амбулаторном порядке к урологу и в среднем 5 000 пациентов получают специализированную помощь в стационаре. Общие затраты на лечение таких пациентов в 2 000 году составили 191 миллион долларов. При этом средние индивидуальные затраты на одного пациента со стриктурной болезнью в три раза выше, чем при иной урологической патологии (10 472 против 3 713 долларов США) [6].
К факторам риска развития стриктуры уретры традиционно относят: пожилой возраст, перенесенные инфекции, передающиеся половым путем, лихенсклероз, осложнения после радикального или лучевого лечения рака предстательной железы [1, 7].
В ретроспективном исследовании E. Palminteri и соавт. проанализировали локализацию стриктур в большой группе, состоящей из 1 439 пациентов, у подавляющего большинства была диагностирована стриктура переднего отдела уретры (92,2%), из них на бульбозный отдел мочеиспускательного канала приходилось 46,9% стриктур, на пенильный 30,5%, пенильный и бульбозный – 9,9%, всю уретру – 4,9% [5]. Этиология стриктур по данным тех же авторов представлена в таблице 1.
Таблица 1. Этиология стриктур передней уретры, % [5]
| Этиология | Пенильный отдел уретры | Бульбозный отдел уретры |
|---|---|---|
| Идиопатическая | 15% | 40% |
| Ятрогенная | 40% | 35% |
| Воспалительная | 40% | 10% |
| Травматическая | 5% | 15% |
В настоящее время в связи с эффективным лечением распространенность гонококковой инфекции в качестве причины стриктуры уретры незначительна, однако в прошлом веке более 90% стриктур уретры являлись следствием нелеченой гонореи [1]. На сегодняшний день воспалительные стриктуры чаще ассоциированы с лихенсклерозом и негонококковыми уретритами. В странах с высоким уровнем развития медицины наиболее часто встречаются стриктуры ятрогенной этиологии. Причиной роста заболеваемости, очевидно, является широкое распространение «малоинвазивных» трансуретральных эндоскопических операций. Катетеризации, цистоскопии, особенно при несоответствии диаметра инструмента просвету уретры, помимо повреждений слизистой оболочки способствуют образованию зон компрессии и ишемии мочеиспускательного канала. Возникновение идиопатических стриктур, по мнению D.E. Andrich и A.R. Mundy, в ряде случаев является результатом нераспознанных в более ранние сроки бессимптомно протекавших незначительных травм или уретритов [4].
В опубликованных в 2014 г. рекомендациях SIU/ICUD внесена ясность в понятия и определения, относящиеся к сужениям мочеиспускательного канала. Так, термин стриктура и стриктурная болезнь относятся только к передней уретре, окруженной спонгиозной тканью. Сужения задней уретры, не связанные с переломом таза, следует обозначать термином стеноз. Правильным термином также является стеноз везикоуретрального анастомоза после простатэктомии. Таким образом, термин «стриктура задней уретры» или «стриктура шейки мочевого пузыря» в настоящее время не является рекомендованным к употреблению [1].
В основе патогенеза стриктуры уретры лежит повреждение эпителия мочеиспускательного канала или прилегающей части спонгиозного тела с последующей плоскоклеточной метаплазией, изменениями внеклеточного матрикса спонгиозной ткани уретры и развитием спонгиофиброза [8, 9]. Нормальная соединительная ткань стенки мочеиспускательного канала замещается плотно-волокнистой с уменьшением соотношения коллагена I и III типов. Эти изменения приводят к снижению доли гладкомышечной ткани и коллагена в спонгиозном теле и, как результат – к уменьшению синтеза оксида азота в области стриктуры, гипоксии ткани и рубцовой прогрессии [10].
С развитием и внедрением в клиническую практику ультразвуковых методов исследования в 1988 году J. McAninch была предложена классификация стриктур, основанная на степени сужения просвета мочеиспускательного канала по сонографической картине [11]. Так же в зарубежной литературе популярна клиническая градация G. Barbagli и соавт., основанная на этиологии заболевания [12]. В нашей стране наиболее известна классификация М.И. Когана. Тем не менее, на сегодняшний день не существует единой и общепринятой классификации стриктурной болезни уретры, что создает клиницистам определенные проблемы.
Симптоматика зависит от степени сужения просвета уретры. Клинически значимые проявления манифестируют при сужении просвета уретры меньше 3-5 мм (1016 Ch). Такие пациенты чаще всего предъявляют жалобы на слабую или тонкую струю мочи, напряжение при мочеиспускании, чувство неполного опорожнения мочевого пузыря, учащенное мочеиспускание или задержку мочи, а также на периодические боли в области мочеиспускательного канала во время и после микции. В анамнезе могут присутствовать рецидивирующие инфекции мочевыводящих путей, простатиты, эпидидимиты, гематурия, микроцистис, камни или дивертикулы мочевого пузыря. Течение стриктурной болезни может осложняться парауретральными абсцессами и свищами [13, 14].
В современной литературе незаслуженно мало внимания уделено проблемам предоперационной диагностики и оперативного планирования. Современный стандарт обследования больного со стриктурой уретры помимо рутинных методов урологическоко скрининга в качестве базового метода диагностики включает ретроградную уретрографию в сочетании с микционной цистоуретрографией. Эта методика позволяет определить локализацию и протяженность стриктуры. Несмотря на свою высокую чувствительность (75-100%) и специфичность (72-97%), уретрография имеет два существенных недостатка. Вопервых, при стандартной косой ¾ укладке пациента возникают проекционные искажения размеров уретры, что может стать причиной недооценки протяженности стриктуры, а, следовательно, и неверного выбора метода хирургического лечения. Во-вторых, ретроградная уретрография не дает представления о глубине и протяженности спонгиофиброза, который является важнейшим фактором в выборе лечебной тактики. Также следует отметить возможность различной интерпретации уретрографии рентгенологами и урологами. Любопытными представляются данные, полученные J.R. Eswara и соавт. , которые предложили оценить 10 уретрограмм 60 ординаторам-урологам и специалистам лучевой диагностики Вашингтонского, Стэнфордского и Северо-западного университетов (США). Правильно ретроградные уретрограммы и нисходящие цистоуретрограммы были интерпретированы 18 из 31 рентгенологов (58%) и 19 из 29 урологов (65%) [15]. В другом исследовании канадские урологи P. Bach и K. Rourke проанализировали описание уретрограмм врачами-рентгенологами в группе из 397 пациентов, перенесших впоследствии уретропластику. Лишь в 49% случаев описание рентгенограмм было адекватным и совпадало с интраоперационной картиной. У 13% пациентов стриктура уретры вообще описана не была [16].
Уретроскопия помогает определить степень сужения уретры. При наличии надлобкового свища иногда целесообразно применять фиброцистоуретроскопию для определения проксимальной границы стриктуры и состояния сфинктерного аппарата. В рекомендациях SIU/ICUD 2014 года относительно диагностической ценности уретроскопии сказано следующее:
- Уретроскопия рекомендована, как наиболее специфичный метод установления наличия стриктуры уретры (уровень доказательности 4А).
- Метод рекомендован как вспомогательный при диагностике стриктур передней уретры в случае неоднозначной трактовки других исследований (уровень доказательности 3В).
С середины 1980-х годов большой интерес у исследователей вызвало появление соноуретрографии, предложенной J.W. McAninch [17]. Чувствительность этого метода диагностики уретральных стриктур колеблется в пределах 66-100%, а специфичность – 97-98%. К сожалению, при выполнении данного исследования точность определения протяженности стриктуры лимитирована 3-5 см [18]. Также к недостаткам метода условно можно отнести то, что врач, производящий исследование, должен обладать высокой квалификацией, как в методике его выполнения, так и в интерпретации полученных данных [19]. Следует отметить общую тенденцию снижения интереса урологов к применению соноуретрографии, о чем в последние годы свидетельствует явное уменьшение количества публикаций, в которых упоминается это исследование. Так, по запросу «Sonourethrography» нами не найдено ни одной статьи в MEDLINE за 2014 и 2015 годы, а за 2013 г. опубликована лишь одна работа. Неоднозначность современных представлений о роли соноуретрографии в диагностике уретральных стриктур нашла свое отражение в рекомендациях SIU/ICUD (2014):
- Соноуретрография может быть использована в качестве дополнения к уретрографии в предоперационном обследовании больных со стриктурой передней уретры (уровень доказательности 2С).
- Соноуретрография может быть более чувствительным методом диагностики, чем ретроградная уретрография в оценке протяженности стриктуры и степени спонгиофиброза, однако, клиническое значение этих результатов остается пока неопределенным (уровень доказательности 2С) [20].
В 2006 г. Y. Osman и соавт. было проведено интересное сравнение диагностической ценности магнитно-резонансной и ретроградной уретрографии [21]. Хотя общая точность диагностики стриктур мочеиспускательного канала двух видов исследованя была равна (85%), магнитно-резонансная уретрография дала дополнительные клинические данные, повлиявшие на выбор метода лечения в 35% случаев. К подобным выводам пришли и корейские ученые D.J. Sung и соавт. [22]. Их исследование показало, что магнитно-резонансная уретрография имеет значительно меньшую погрешность измерения протяженности стриктуры, чем ретроград-ная уретрография в сочетании с микционной цистоуретрографией. Другим основным преимуществом магнитно-резонансной уретрографии является возможность точно оценить изменения спонгиозного тела уретры. Позднее ученые из клиники Mayo B. Kim, A. Kawashima и A.J. LeRoy, анализируя достоверность методов диагностики патологии мужской уретры, отвели первостепенное значение магнитно-резонансной томографии по сравнению с ретроградной уретрографией, соноуретрографией и КТ [23]. С модернизацией магнитно-резонансных томографов претерпевают изменения и методики исследования. В нашей стране специалистами Ростовского государственного медицинского университета в 2012 г. была предложена динамическая магнитно-резонансная ретроградная и антеградная спонгиоуретротомография [24]. Авторы пришли к выводу, что информативность магнитно-резонансной уретрографии в изучении стриктурной болезни уретры приближается к информативности морфологического исследования макропрепарата этого органа.
Таким образом, приведенные данные свидетельствуют о перспективности применения магнитно-резонансной уретрографии, как для выявления стриктур мочеиспускательного канала, так и для уточнения их локализации и длины, а самое главное глубины и протяженности спонгиофиброза, что является необходимым условием для качественного оперативного планирования. Нерешенными проблемами остаются дороговизна и ограниченная доступность в сочетании с отсутствием стандартизированного протокола данного исследования.
Диагностика стриктур уретры должна включать оценку степени обструкции нижних мочевых путей. Необходимым считается проведение урофлоуметрии и заполнение па-циентом опросников «IPSS» и «МИЭФ-5» [20]. Эти методы являются базовыми и для послеоперационного мониторинга больных, хотя общепринятых стандартов послеоперационного наблюдения до сих пор не выработано.
В недавнем прошлом считалось, что при лечении сужений мочеиспускательного канала необходимо придерживаться так называемой «хирургической лестницы», т.е. прежде чем приступить к сложным открытым методам коррекции, необходимо использовать простые, пусть не всегда эффективные, но доступные методы лечения, такие как бужирование и внутренняя оптическая уретротомия. В настоящее время такой подход считается устаревшим.
В целом методы лечения стриктур мочеиспускательного канала можно разделить на эндоуретральные и открытые оперативные вмешательства. Наиболее древний и широко известный способ лечения – бужирование (дилатация) уретры. Метод является мало затратным и вполне выполним в амбулаторных условиях. Однако, незначительная эффективность (менее 10%), высокая частота рецидивов и осложнений обусловливают ограниченность показаний к использованию данной методики.
Сопоставимые с бужированием результаты лечения достигаются применением внутренней оптической уретротомии, как правило, «холодным ножом» или различными видами лазеров: (диодные, титанил-фосфат-калиевые, алюмоиттриевый гранат, легированный ионами неодима, гольмиевые и эксимерные) [25]. Несмотря на то, что в настоящее время в США около 20% урологов используют лазерные технологии для лечения стриктур уретры, применение данной методики не рекомендовано ввиду сопоставимости результатов лечения с внутренней оптической уретротомией при значительно больших финансовых затратах [26]. Начиная с 70-х годов 20 века, для снижения частоты рецидивов было предложено интраоперационно в область рубцовой ткани под слизистую оболочку вводить фармакологические препараты, обладающие антиколлагеновым и антифибробластным эффектами. Исследовали стероидные препараты, цитостатики (Митомицин С), ингибиторы циклооксигеназы 2 типа, глюкокортикоиды, однако к значимому увеличению эффективности это не привело [27-29]. Интенсивно изучался вопрос использования уретральных стентов в сочетании с внутренней оптической уретротомией, но из-за высокой частоты осложнений (боль в промежности, рубцевание, миграция стента, инкрустация камнями, недержание мочи, инфицирование) эти методы не нашли широкого применения в повседневной практике [30, 31].
Таким образом, согласно современным рекомендациям бужирование и внутренняя оптическая уретротомия могут быть использованы как первая линия лечения лишь у пациентов с короткими (менее 1 см), единичными стриктурами бульбозного отдела уретры без выраженного спонгиофиброза [32]. Однако, у ослабленных больных или у пациентов, отказавшихся от радикального лечения, применение эндоуретральных процедур возможно в качестве паллиативного метода лечения. Несмотря на то, что эффективность эндоуретральных методов не превышает 10-35%, большинство урологов, как в нашей стране, так и за рубежом не спешат отказываться от их применения. По мнению многих авторов, неоправданное повсеместное применение эндоскопических методик и игнорирование показаний к открытой уретропластике может привести к росту заболеваемости протяженными стриктурами передней уретры в будущем [33].
Открытые операции в современной реконструктивной хирургии уретры являются наиболее предпочтительными при стриктурной болезни, т.к. обладают высокой эффективностью, характеризуются малой частотой осложнений и хорошими отдаленными результатами.
Несмотря на то, что анастомотическая уретропластика выполняется более 100 лет, к настоящему времени не проведено ни одного проспективного и рандомизированного исследования, посвященного этому виду оперативного лечения. Все работы являются ретроспективными когортными исследованиями. Большинство экспертов сходятся во мнении, что:
- Показанием для анастомотической уретропластики являются стриктуры бульбозного отдела уретры, протяженность которых не превышает 2-3 см.
- Выполнение анастомоза при стриктурах пенильного отдела уретры не рекомендовано, т.к. связано с высоким риском укорочения и искривления полового члена.
- Анастомоз должен сопровождаться спатуляцией краев резецированной уретры, что существенно снижает риск рецидива.
Анализ публикаций показывает, что анастомотическая уретропластика успешна более чем в 90% случаев [34]. Следует отметить, что выполнение спатуляции увеличивает натяжение краев примерно на 11,5 см. Поэтому в пограничных случаях (протяженность стриктуры 2,53 см) следует отдавать предпочтение увеличительно-анастомотическим методикам или аугментации уретры [35].
Недавно предложенная оригинальная техника нетранссекционного анастомоза по Andrich-Mundy позволяет сохранить осевой кровоток спонгиозного тела уретры [36]. Однако эта операция не показана при посттравматических стриктурах. Также следует отметить сопоставимую по сравнению с обычным анастомозом эффективность, при большей технической сложности этой операции. Поэтому, учитывая малое количество публикаций и отсутствие данных об отдаленных результатах, судить о том, какое место должна занимать данная операция в арсенале современного уролога пока затруднительно.
В основе заместительной уретропластики лежит концепция частичного или полного замещения просвета уретры лоскутом тканей. Несмотря на многообразие, все эти операции можно разделить на 3 группы:
- Увеличительная уретропластика (аугментация уретры, аугментация с анастомозом).
- Этапная уретропластика.
- Уретропластика трубчатыми лоскутами.
В качестве пластического материала используют свободные (лишенные связи с донорским местом) и перемещенные (на питающей ножке) лоскуты. Свободные лоскуты принято назвать трансплантатами, а операцию – трансплантация, в случае с перемещенными лоскутами применяется термин транспозиция. В англоязычной литературе применительно к свободным лоскутам употребляется термин «Graft» – черенок. Перемещенные лоскуты носят название «Flap» – откидная створка. Соответственно и операции называют «Grafting» и «Flaping». Оба эти метода используют для аугментации уретры. Среди свободных лоскутов (трансплантатов) наибольшее распространение получило применение слизистой полости рта (буккальный и лингвальный лоскуты), реже используют кожу препуция, а среди перемещенных – препуциальный и пенильный лоскуты на фасциальной питающей ножке. От применения кожи мошонки в настоящее время отказались из-за наличия в ней волосяных фоликулов. Применение лоскута слизистой оболочки ротовой полости для заместительной уретропластики впервые было предложено отечественным ученым К.М. Сапежко в 1894 г. [37]. По мнению ведущих мировых экспертов буккальная слизистая является идеальным пластическим материалом для пересадки в уретру [19, 38]. Это объясняется следующими обстоятель ствами:
- развитостью субэпителиальной сосудитой сети.
- хорошими прочностно-эластическими свойствами.
- устойчивостью к инфекции.
- высокой регенеративной способностью донорского места.
В последние годы ведутся работы в области применения в качестве пластического материала продуктов тканевой инженерии [39, 40]. Но эти публикации пока носят эпизодический характер, и, несмотря на очевидную перспективность, в данном обзоре рассматриваться не будут.
«Золотым стандартом» одноэтапного лечения протяженных стриктур бульбозного отдела уретры признана увеличительная (аугментационная) уретропластика, заключающаяся в увеличении просвета мочеиспускательного канала за счет продольно расположенного в виде заплаты лоскута.
Эффективность этих операций по данным литературы колеблется в пределах 85-100% [35]. Латеральная аугментация уретры используется сравнительно редко. Результаты дорзального и вентрального способа фиксации трансплантата при аугментации бульбозного отдела уретры являются сопоставимыми и составляют примерно 85% [41]. При вентральном способе огромное значение имеет глубина и локализация спонгиофиброза, т.к. спонгиозное тело уретры является в этом случае питающим ложем для трансплантата и от его кровоснабжения зависит результат операции.
При коррекции стриктур пенильного отдела уретры вентральная аугментация свободными лоскутами не рекомендована. Это связано с анатомией мочеиспускательного канала, т.к. в пенильном его отделе толщина спонгиозного тела по вентральной поверхности недостаточна для хорошего укрытия трансплантата. Поэтому, как метод вентральной аугментации пенильной уретры, единственной актуальной на сегодняшний день остается операция Orandi (1968) c применением пенильного кожно-фасциального перемещенного лоскута. Однако, частое образование послеоперационных свищей сделало эту операцию значительно менее популярной в последние годы по сравнению с дорзальной аугментацией уретры буккальным трансплантатом. Также весьма эффективна дорзо-латеральная аугментация уретры (операция Kulkarni). В 2001 году H.S. Asopa предложил проводить дорзальную аугментацию уретры через вентральный сагиттальный уретротомический доступ (техника H.S. Asopa), преимуществом этих двух методик является отсутствие необходимости мобилизации дорзальной части уретры. Несколько позднее при операциях на бульбозном отделе уретры E. Palminteri и соавт. дополнили технику H.S. Asopа, вшивая дополнительный вентральный аутотрансплантат [42].
В целом эффективность аугментации пенильного отдела уретры по данным литературы находится в пределах 87% [19, 43].
В случаях высокого риска рецидива (наличие множественных уретральных свищей, пануретральные стриктуры, облитерации уретры, тяжелые формы лихенсклероза, многочисленные неудачные попытки уретропластики) выполняются двухэтапные операции. Если уретра может быть использована, то на первом этапе лечения продольно рассекают суженный участок уретры с подшиванием рассеченных краев к коже, в остальных случаях измененную уретру полностью иссекают c формированием широкой площадки из пластического материала (кожный лоскут, слизистая щеки). На втором этапе, через 6-12 месяцев, формируют уретру путем тубуляризации [44]. Следует отметить, что название 2-х этапная уретропластика носит весьма условный характер, т.к. по данным G. Barbagli частота осложнений, требующих последующей коррекции, для первого этапа составляет 10-39%, а для второго – около 30%. Также следует учитывать длительность лечения, которое иногда растягивается на годы и требует значительного терпения, как от пациента, так и от врача. Многие авторы считают, что в особо сложных случаях выполнение перинеостомы является разумным выходом из ситуации. Несмотря на приведенные выше данные, конечная эффективность многоэтапной уретропластики весьма высока и варьирует по данным литературы в пределах 78-100% [19].
Эффективность уретропластики тубуляризованными лоскутами значительно ниже, чем при двухэтапных операциях и составляет от 45 до 80%. От использования лучевого и торокодорзального лоскутов в настоящее время отказались в связи с низкой эффективностью этих операций.
По мнению многих авторов коррекция стриктур ладьевидной ямки является самым сложным разделом в уретральной хирургии. Это объясняется тем, что помимо восстановления просвета уретры хирург должен решать и эстетические проблемы, связанные с внешним видом головки полового члена после операции. Следует помнить, что именно в ладьевидной ямке происходит превращение турбулентного потока мочи в ламинарный и уретропластика в этой зоне предъявляет к хирургу особые требования. Существует огромное многообразие оперативных методик, предложенных для коррекции стриктур головчатого отдела уретры. Еще одним важным обстоятельством, влияющим на выбор метода оперативного лечения, является этиология стриктур ладьевидной ямки. И по этому признаку все стриктуры головчатого отдела уретры можно разделить на стриктуры, ассоциированные с лихенсклерозом и другие, чаще всего ятрогенные [19]. Особенностью стриктур связанных с лихенсклерозом является то, что в качестве пластического материала подходят только экстрагенитальные лоскуты, т.к. генитальная кожа считается потенциально больной и ее использование ведет к многократному возрастанию количества рецидивов [45].
При протяженных стриктурах головчатого отдела уретры, ассоциированных с лихенсклерозом, применяются одноили двухэтапные операции с пересадкой слизистой щеки. Их эффективность согласно литературным данным составляет 72-93% [35]. Согласно рекомендациям SIU/ICUD (2014) одноэтапные операции применимы, когда просвет уретры составляет не менее 6 Сh. Большинство авторов в этих случаях применяют методику «Snodgraft», при выполнении которой делается разрез слизистой дорзальной стенки уретры и в образовавшийся овальный дефект вшивается буккальный лоскут [46]. При двухэтапной операции уретра полностью иссекается и на первом этапе фиксируется широкий буккальный лоскут. Вторым этапом выполняется его тубуляризация и гланулопластика.
Для коррекции стриктур ладьевидной ямки не связанных с лихенсклерозом предложено множество операций. Эти операции демонстрировали хорошие функциональные результаты, но не устраивали с косметической точки зрения [38]. В связи с этим в последние годы наибольшее распространение получили методики вентральной аугментации уретры перемещенным препуциальным лоскутом. Размеры лоскута при транпозиции необходимо подбирать таким образом, чтобы просвет ладьевидной ямки был не менее 24 Ch.
Согласно литературным данным эффективность этих операций приближается к 100% с хорошим косметическим результатом [19].
За последние полвека было предложено множество различных способов коррекции стриктурной болезни уретры, что привело к качественному прогрессу в лечении данной патологии. Среди современных тенденций в развитии этой области урологии можно выделить следующие:
- Значительное снижение показаний и скептическое отношение специалистов к применению эндоуретральных методов лечения (бужирование, внутренняя оптическая уретротомия).
- Большинство оперирующих урологов отдает предпочтение трансплантации слизистой полости рта, считая буккальный лоскут идеальным пластическим материалом для пересадки в уретру.
- Явное снижение интереса к пересадке кожно-фасциальных лоскутов.
- Весьма перспективным представляется использование продуктов тканевой инженерии.
- Появление новых видов анастомотической уретропластики (анастомоз без пересечения спонгиозного тела уретры).
Несмотря на значительные успехи в лечении стриктуры уретры, хотелось бы выделить и основные нерешенные проблемы:
- современные стандарты диагностики стриктуры уретры не позволяют судить о глубине и протяженности спонгиофиброза, что, очевидно, может влиять, как на оперативное планирование, так и на результат уретропластики. В этом смысле перспективным направлением можно считать внедрение метода магнитно-резонансной уретрографии в широкую практику;
- большинство исследований носит ретроспективный когортный характер, что делает невозможным составление клинических рекомендаций европейского и национального уровней. В связи с этим представляется целесообразным учреждение в нашей стране региональных центров хирургии уретры и организация многоцентровых проспективных исследований;
- отсутствие четких клинических рекомендаций является причиной нынешней сложившейся ситуации с повсеместным неоправданным применением бужирования и внутренней оптической уретротомии, что ведет к прогрессии болезни и увеличению частоты протяженных стриктур;
- отсутствие общепринятой классификации уретральных стриктур;
- отсутствуие единых стандартов оценки результатов оперативного лечения и послеоперационного мониторинга больных;
- нерешенной является проблема одноэтапной коррекции пануретральных стриктур и сложных случаев лихенсклероза;
- практическое отсутствие работ, посвященных адаптации буккальной слизистой к новым условиям. Исследования в этой области могут представлять не только научный, но и клинический интерес в отношении послеоперационного прогноза.
ЛИТЕРАТУРА
1. Latini JM, McAninch JW, Brandes SB, Chung JY, Rosenstein D. SIU/ICUD Consultation on urethral strictures: epidemiology, etiology, anatomy, and nomenclature of urethral stenoses, strictures, and pelvic fracture urethral disruption injuries. Urology 2014;83(3):1–7.
2. Коган М.И. Стриктуры уретры у мужчин: реконструктивно-восстановительная хирургия: иллюстрированное руководство. М.: Практическая медицина, 2010. 139 с.
3. Anger JT, Buckley JC, Santucci RA, Elliott SP, Saigal CS. Trends in stricture management among male Medicare beneficiaries: underuse of urethroplasty. Urology 2011;77(2):481–485.
4. Mundy AR, Andrich DE. Urethral strictures. BJU International 2011;107(1):6–26.
5. Palminteri E, Berdondini E, Verze P, De Nunzio C, Vitarelli A, Carmignani L. Contemporary urethral stricture characteristics in the developed world. Urology 2013;81 (1):191–196.
6. Santucci RA, Joyce GF, Wise M. Male urethral stricture disease. J Urol 2007;177:1667–1674.
7. Liu JS, Walker K, Stein D, Prabhu S, Hofer MD, Han J, et al. Lichen sclerosus and isolated bulbar urethral stricture disease. J Urol 2014;92(3):775–779.
8. Chambers RM, Baitera B. The anatomy of the urethral stricture. Br J Urol 1977;49(5): 545–551.
9. Cavalcanti A, Costa WS, Baskin LS, McAninch JA, Sampaio FJ. A morphometric analysis of bulbar urethral strictures. BJU Int 2007;100(2):397–402.
10. Cavalcanti A, Yucel S, Deng DY, McAninch JW, Baskin LS. The distribution of neuronal and inducible nitric oxide synthase in urethral stricture formation. J Urol 2004;171:1943–1947.
11. McAninch JW, Laing FC, Jeffrey RJ. Sonourethrography in the evaluation of urethral stricture: a preliminary report. J Urol 1988;139(2):294–297.
12. Barbagli G, Palminteri E, Lazzeri M. Anterior urethral strictures. BJU Int 2003;92(5): 497–505.
13. Bertrand LA, Warren GJ, Voelzke BB, Elliott SP, Myers JB, McClung CD, et al. Lower Urinary Tract Pain and Anterior Urethral Stricture Disease: Prevalence and Effects of Urethral Reconstruction. J Urol 2015;193(1):184–189.
14. Hampson LA, McAninch JW, Breyer BN. Male urethral strictures and their management. Nat Rev Urol 2014;11(1):43–50.
15. Eswara JR, Song JB, Chang AJ, Rosenstein DI, Gonzalez CM, Vetter JM, et al. Urethrography interpretation skills of urology and radiology residents at tertiary care medical centers. Urology 2014;83(6):1239–1242.
16. Bach P, Rourke K. Independently interpreted retrograde urethrography does not accurately diagnose and stage anterior urethral stricture: the importance of urologist-performed urethrography. Urology 2014;83(5):1190–1194.
17. McAninch JW, Laing FC, Jeffrey RBJr. Sonourethrography in the evaluation of urethral strictures: a preliminary report. J Urol 1988;139(2):294–297.
18. Maciejewski C, Rourke K. Imaging of urethral stricture disease. Transl Androl Urol 2015;4(1):2–9.
19. Brandes SB, Morey AF. Advanced Male Urethral and Genital Reconstructive Surgery, 2-nd ed. New York : Springer, 2014. 751 р.
20. Angermeier KW, Rourke KF, Dubey D, Forsyth RJ, Gonzalez CM. SIU/ICUD Consultation on Urethral Strictures: Evaluation and follow-up. Urology 2014;83(3):8–17.
21. Osman Y, El-Ghar MA, Mansour O, Refaie H, El-Diasty T. Magnetic resonance urethrography in comparison to retrograde urethrography in diagnosis of male urethral strictures: is it clinically relevant. Eur Urol 2006;50(3):587–593.
22. Sung DJ, Kim YH, Cho SB, Oh YW, Lee NJ, Kim JH, et al. Obliterative urethral stricture: MR urethrography versus conventional retrograde urethrography with voiding cystourethrography. Radiology 2006;240(3):842–848.
23. Kim B, Kawashima A, LeRoy AJ. Imaging of the male urethra. Ultrasound CT MR 2007;28(4):258–273.
24. Банчик Э.Л., Минеев Н.И., Митусов В.В., Домбровский В.И., Коган М.И. Магнитно-резонансная томография полового члена. Нормальная анатомия. Вестник рентгенологии и радиологии 2012;(5):40–47
25. Dubey D. The current role of direct vision internal urethrotomy and self-catheterization for anterior urethral strictures. Indian J Urol 2011;27(3):392-396.
26. Dutkiewicz SA, Wroblewski M. Comparison of treatment results between holmium laser endourethrotomy and optical internal urethrotomy for urethral stricture. Int Urol Nephrol 2012;44(3):717–724.
27. Vanni AJ, Zinman LN, Buckley JC. Radial urethrotomy and intralesional mitomycin c for the management of recurrent bladder neck contractures. J Urol 2011;186(1):156–160.
28. Tavakkoli TK, Yarmohamadi A. Triamcinolone injection following internal urethrotomy for treatment of urethral stricture. J Urol 2011;8(2):132–136.
29. Mazdak H. Internal urethrotomy and intraurethral submucosal injection of triamcinolone in short bulbar urethral strictures. Int Urol Nephrol 2010;42(3):565–568.
30. McKenzie P, Badlani G. Critical appraisal of the Spanner™ prostatic stent in the treatment of prostatic obstruction. Med Devices (Auckl.) 2011;4:27–33.
31. Sertcelik MN, Bozkurt IH, Yalcinkaya F, Zengin K. Long-term results of permanent urethral stent Memotherm implantation in the management of recurrent bulbar urethral stenosis. BJU Int 2011;108(11):1839–1842.
32. Buckley JC, Heyns C, Gilling P, Carney J. SIU/ICUD Consultation on urethral strictures: dilation, internal urethrotomy, and stenting of male anterior urethral strictures. Urology 2014;83(3):18–22.
33. Bandhauer K. Historical Highlights in the Development of Urethral Surgery. Schreiter F., Jordan G.H. // In Reconstructive urethral surgery. 2006. P. 5–11.
34. Morey AF, Watkin N, Shenfeld O, Eltahawy E, Giudice C. SIU/ICUD Consultation on urethral strictures: anterior urethra – primary anastomosis. Urology 2014;83(3):23–26.
35. Chapple C, Andrich D, Atala A, Barbagli G, Cavalcanti A, Kulkarni S, et al. SIU/ICUD Consultation on Urethral Strictures: The management of anterior urethral stricture disease using substitution urethroplasty. Urology 2014;83(3):31–47.
36. Andrich DE, Mundy AR. Non-transecting anastomotic bulbar urethroplasty: a preliminary report. BJU Int 2012;109(7):1090–1094.
37. Сапежко К.М. К лечению дефектов уретры путем пересадки слизистой оболочки. Хирургическая летопись 1894;4(кн. 5):775–784.
38. Wein AJ, Kavoussi LR, Partin AW, Peters CA. Campbell-walsh urology, 11th ed. Philadelphia : Elsevier, 2015. 3704 р.
39. Osman NI, Hillary C, Bullock AJ, MacNeil S, Chapple CR. Tissue engineered buccal mucosa for urethroplasty: progress and future directions. Adv Drug Deliv 2015;82-83:69-76.
40. Cui T, Terlecki R, Atala A. Tissue engineering in urethral reconstruction. Arch Esp Urol 2014;67(1):29–34.
41. Lumen N, Oosterlinck W, Hoebeke P. Urethral reconstruction using buccal mucosa or penile skin grafts: systematic review and meta-analysis. Urol Int 2012;89(4):387–394.
42. Palminteri E, Manzoni G, Berdondini E, Fiore F, Testa G, Poluzzi M, et al. Combined dorsal plus ventral double buccal mucosa graft in bulbar urethral reconstruction. Eur Urol 2008;53 (1):81–90.
43. Lozano JL, Arruza A. Substitution urethroplasty. Long term follow up results in a group of 50 patients. Arch Esp Urol 2015;68 (4):424–428.
44. Schreiter F, Noll F. Mesh graft urethroplasty using split thickness skin graft or foreskin. J Urol 1989;142(5):1223–1226.
45. Belsante MJ, Selph JP, Peterson AC. The contemporary management of urethral strictures in men resulting from lichen sclerosus. Transl Androl Urol 2015;4(1):22–28.
46. Silay MS, Sirin H, Tepeler A, Karatag T, Armagan A, Horasanli K. Snodgraft technique for the treatment of primary distal hypospadias: pushing the envelope. Urol 2012;188(3):938–942.









Комментарии