Качмазов А.А., Кешишев Н.Г., Гурбанов Ш.Ш., Ковченко Г.А., Осипов О.В., Григорьева М.В., Казаченко А.В., Сивков А.В., Алексеев Б.Я.
В Европе и США вместо общепринятого в России термина «аденомэктомия» используют понятие «простая простатэктомия». Для удобства восприятия материала, а также в соответствии с традициями урологической номенклатуры, принятыми Российским обществом урологов, в данной статье вместо терминов «открытая простая простатэктомия», «экстраперитонеоскопическая простая простатэктомия», «роботическая простая простатэктомия» будут использованы «открытая аденомэктомия (ОА)» «экстраперитонеоскопическая аденомэктомия (ЭА)», «роботическая аденомэктомия (РА)», соответственно. При ОА энуклеация аденоматозных узлов может быть выполнена посредством вскрытия передней стенки мочевого пузыря (Freyer procedure) или капсулы предстательной железы по передней поверхности (Millin procedure).
Согласно рекомендациям Европейской Ассоциации Урологов от 2016 года ОА наряду с эндоскопической энуклеацией (гольмиевая, биполярная) является оперативным вмешательством первой линии у больных с доброкачественной гиперплазией предстательной железы (ДГПЖ) больших размеров, более 80 см3 (уровень доказательности 1a) [1].
В последние 10 лет в связи с внедрением минимально инвазивных технологий (лапароскопия, робот Da Vinci), в литературе появились публикации, посвященные особенностям выполнения и эффективности экстраперитонеоскопической и РА у больных с ДГПЖ больших размеров. Эти методики объединены в группу минимальной инвазивной аденомэктомии (МИА) (уровень доказательности 2) (рис. 1).
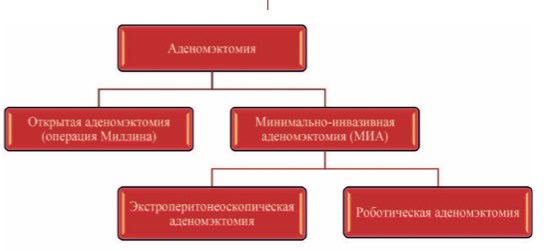
Рис. 1. Методы выполнения простой простатэктомии
Техника ЭА впервые была описана M.B., Mariano и соавт. в 2002 году [2]. Авторы представили клинический случай применения ЭА у больного с объемом предстательной железы 173 см3. Из особенностей хирургической техники, следует отметить прошивание дорзального комплекса, как при радикальной простатэктомии, а также продольное рассечение капсулы предстательной железы по передней поверхности. Кровопотеря составила 800 мл, длительность операции 225 минут.
Несколько позже, в 2008 году, появилась первая публикация об эффективности РА у больных ДГПЖ больших размеров [3]. Было прооперировано 7 пациентов. Средний объем предстательной железы составил 77,66 см3, кровопотеря – 289 мл (от 60 до 800), длительность операции – 205 минут (от 120 до 300), длительность госпитализации – 1,4 дней (от 1 до 2), длительность дренирования мочевого пузыря – 7 дней (от 6 до 9). Страховой дренаж был удален через 3,75 дней (от 3 до 4). Отмечено статистически достоверное улучшение по шкале IPSS и максимальной скорости мочеиспускания (Qmax). Осложнений не было.
Метаанализ 27 работ, включающих 764 пациентов с ДГПЖ больших размеров, которым выполняли МИА, показал увеличение Qmax в послеоперационном периоде в среднем до 14,3 мл/с (95% CI 13,1-15,6), снижение IPSS до 17,2 (95% CI 15,219,2). Длительность операции составила 141 мин (95% CI 124-159), кровопотеря – 284 мл (95% CI 243325). Интраоперационные осложнения (кровотечение) были выявлены у 13,6% больных. При сравнении МИА с ОА определена статистически достоверная разница в пользу МИА по длительности госпитализации (WMD – 1,6 days, p=0,02), времени катетеризации мочевого пузыря (WMD – 1,3 days, p=0,04) и объему кровопотери (WMD – 187mL, p=0,015) [4].
В вышеописанный метаанализ не вошла интересная работа, опубликованная в июле 2015 года, которая объединила результаты МИПП 23-х независимых урологических центров Европы и Америки. В анализ было включено 1330 пациентов: 487 (36,6%) – после РА, 843 (63,4%) – после ЭА. Средний объем предстательной железы составил 100 мл (от 89 до 128), кровопотеря – 200 мл (от 150 до 300). Интраоперационное кровотечение было выявлено у 2,2% больных, конверсия в открытую операцию потребовалась в 3% случаев. Длительность госпитализации составила 4 дня (от 3 до 5), послеоперационные осложнения (grade 1) отмечены у 10,6% пациентов. Через 12 месяцев после операции было определено статистически достоверное улучшение по шкале IPSS и основным уродинамическим показателям (Qmax, остаточная моча). Авторы пришли к заключению, что МИПП, независимо от технологии (ЭА или РА), является эффективным и безопасным методом хирургичского лечения ДГПЖ больших размеров [5].
В сентябре 2015 года опубликована еще одна статья, объединяющая результаты РА 4-х европейских центров (Бельгия, Греция) [6]. В исследование было включено 67 пациентов, которым была выполнена РА. Средний объем предстательной железы составил 129 мл (104-180), длительность операции – 97 мин (80-127), кровопотеря – 200 мл (115360). Послеоперационные осложнения выявлены у 30% больных, включая трех пациентов с массивным кровотечением (grade 3), что потребовало выполнения цистоскопии и коагуляции кровоточащих сосудов. Уретральный катетер удален на 3-й день (2-4) после операции, пациенты выписывались домой в среднем через 4 дня (3-5). Результаты лечения оценивали через 6 мес. (2-12). После операции IPSS составил 3 (0-8) балла, Qmax – 23 мл/с (1635), объем остаточной мочи – 0 мл. Все послеоперационные показатели имели статистически достоверные различия при сравнении с базовыми значениями, p<0,001. Авторы сделали вывод о том, что РА имеет хорошие функциональные результаты и низкий риск осложнений.
В НИИ урологии и интервенционной радиологии им. Н.А. Лопаткина 2015 год выполнено 6 ЭА у больных ДГПЖ больших размеров. Медиана объема гиперплазированных узлов предстательной железы составила 165 см3 (136:190), IPSS – 23 (22:25), Qmax – 8 мл/с (7:9), остаточной мочи 65 мл (50:70), длительности операции – 112,5 мин (100:125), кровопотеря – 300 мл (200:500), длительности катетеризации мочевого пузыря – 7,5 дней (7:8). Осложнений не было. У двух больных после энуклеации гиперплазированных узлов предстательной железы удалили камни мочевого пузыря (через шейку) с максимальными размерами 2,5 см и 3,0 см. Через 1 месяц после операции зарегистрировано статистически достоверное (p<0,05) уменьшение суммарного показателя по шкале IPSS до 9,5 (8:11), увеличение Qmax до 22,5 мл/с (21:24), уменьшение объема остаточной мочи до 0 мл. Несомненно для более объективной оценки эффективности ЭА необходимо продолжить набор клинического материала.
Таким образом, на основании анализа литературных данных, становится очевидным, что существует большое число различных публикаций, посвященных эффективности МИПП при ДГПЖ больших размеров. Обращает на себя внимание отсутствие данных об отдаленных результатах лечения, поэтому, на сегодняшний день МИА – это «исследуемая операция», имеющая уровень доказательности 2. Необходимо проведение дальнейших широкомасштабных исследований, сравнивающих эффективность, стоимость и кривую обучения МИА с ОА и эндоскопическими методами энуклеации [1]. В данной статье будут рассмотрены технические аспекты выполнения ЭА у больных с ДГПЖ больших размеров.
ЭТАПЫ ЭА
Операцию выполняем под эндотрахеальным наркозом. Укладка больного (положение Тренделенбурга) и расстановка троакаров соответствуют стандартной экстраперитонеоскопической радикальной простатэктомии (рис. 2).
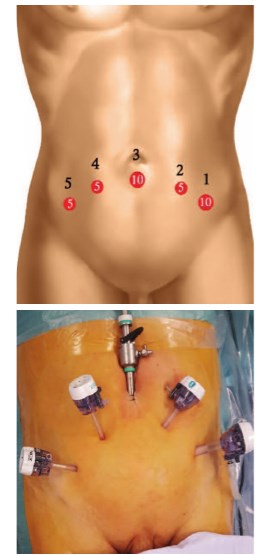
Рис. 2. Положение троакаров (1-5 – порты)
Троакар №1 должен быть толщиной 10 (12) мм, так как через этот порт впоследствии осуществляем тракцию гиперплазированных узлов предстательной железы. Трокары 4, 5 (троакары ассистента) устанавливаем стандартно. Допустимо использование только одного троакара толщиной 5 мм.
Операцию начинаем с создания рабочего пространства, установки троакаров. Тупым и острым путем выделяем переднюю поверхность капсулы предстательной железы (рис. 3).
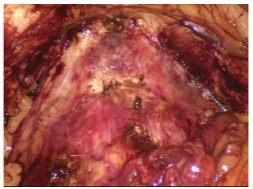
Рис. 3. Создание рабочего пространства. Выделение капсулы предстательной железы по передней поверхности
Далее выполняем поперечное рассечение капсулы предстательной железы (рис. 4). Этот этап является очень важным, так как успех последующей энуклеации гиперплазированных узлов напрямую зависит от рассечения капсулы непосредственно до аденоматозной ткани. При несоблюдении этого принципа возможно развитие активного кровотечения за счет разволокнения капсулы и повреждения венозных сосудов. Для безопасного рассечения капсулы целесообразно использовать инструменты, обеспечивающие мощный коагуляционный эффект (LigaSure 5 мм, HARMONIC 5 мм и т.п.).
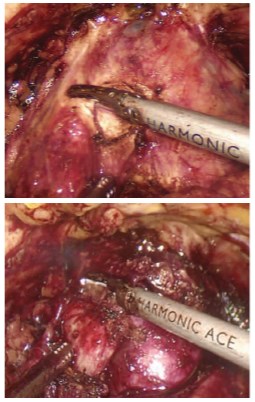
Рис. 4. Поперечное рассечение капсулы предстательной железы по передней поверхности (А – вид до рассечения капсулы, Б – вид после рассечения капсулы).
Следующим этапом производим энуклеацию гиперплазированных узлов по передней поверхности предстательной железы (рис. 5). Тракцию капсулы хирург осуществляет левой рукой любым зажимом (Babcock 5 мм и т.д.). Правой рукой, используя отсос или коагулирующий инструмент (5 мм), хирург аккуратно отслаивает гиперплазированную ткань от капсулы. При выявлении сосудов необходимо их тщательно коагулировать, потом пересекать. После выделения правого и левого гиперплазированных узлов по передней поверхности выполняется их продольное рассечение по «срединной борозде». При этом предварительно устанавливаем уретральный катетер, который послужит ориентиром при последующей энуклеации и отделении гиперплазированной ткани от шейки мочевого пузыря.
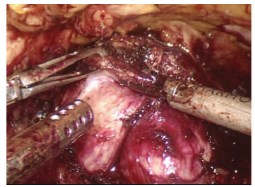
Рис. 5. Энуклеация гиперплазированных узлов по передней поверхности
Далее, используя любой grasper (предпочтительнее Claw forceps, 2×3 teeth, длина рабочей части 35 мм, толщина инструмента 10 мм), левой рукой хирург последовательно осуществляет тракцию правой и левой долей ДГПЖ (рис. 6). Правой рукой, используя отсос или коагулирующий инструмент (5 мм), тупым и острым путем, хирург отслаивает гиперплазированную ткань от боковой и нижней поверхности капсулы предстательной железы.
После удаления гиперплазированной ткани осуществляем тщательный гемостаз. При наличии камня(ей) мочевого пузыря производим их удаление через шейку (рис. 7). Удаление мелких камней может осуществляться при помощи обычных зажимов толщиной 5 или 10 мм, однако при наличии крупных конкрементов (более 2,5 см), желательно применять зажимы типа Babcock толщиной 10 мм с длинными браншами (более 30 мм) и различными модификациями их кончиков (claw forceps 2×3 teeth и т.д.).
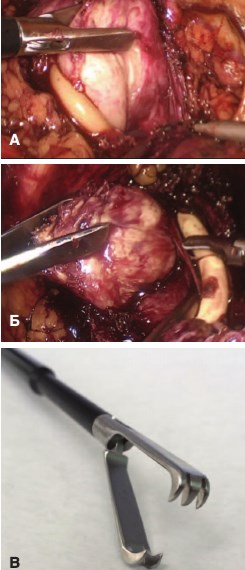
Рис. 6. Энуклеация правой (А) и левой (Б) доли ДГПЖ. Grasper claw forceps, 2×3 teeth (В)
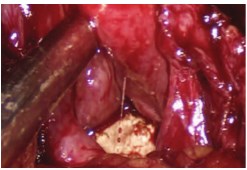
Рис.7. Удаление камня мочевого пузыря (диаметр камня 2,5 см) через шейку мочевого пузыря
После удаления камней мочевого пузыря выполняем окончательный гемостаз. Производим замену уретрального катетера (Foley №20), раздуваем баллон на 1520 мл. За счет небольшого натяжения катетера несколько сохраняем ложе гиперплазированной ткани предстательной железы (рис. 8).
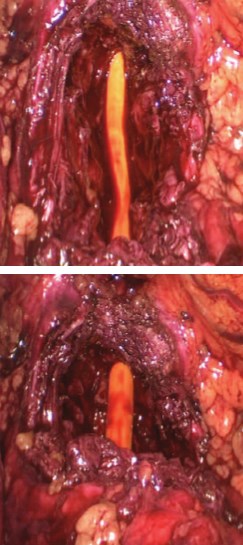
Рис. 8. Ложе ДГПЖ. Натяжение уретрального катетера. Баллон катетера Foley №20 раздут на 20 мл
Далее производим ушивание передней капсулы предстательной железы непрерывным швом (Vicryl 3-0, V-Loc 3-0) (рис. 9).
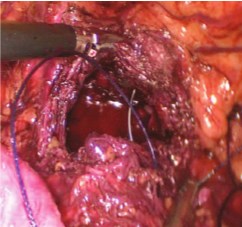
Рис. 9. Ушивание передней капсулы предстательной железы
Устанавливаем страховой дренаж, через порт №1 удаляем гиперплазированные ткани предстательной железы. На рисунке 10 представлен окончательный вид раны больного через 1 неделю после операции.
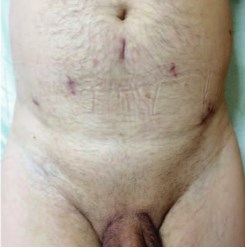
Рис. 10. Рана больного через 1 неделю после операции
ВЫВОДЫ
1. ЭА – это малоинвазивная операция с хорошим косметическим эффектом, повторяющая все этапы открытой аденомэктомии.
2. ЭА может быть выполнена в любом урологическом стационаре, оснащенном лапароскопической стойкой с минимальным набором лапароскопического оборудования (троакары, LigaSure 5 мм /HARMONIC 5 мм, зажимы, диссектор, иглодержатель и шовный материал).
3. Хирург, выполняющий ЭА, должен владеть техникой интракорпорального непрерывного шва и иметь опыт ОА.
4. Необходимо проведение дальнейших широкомасштабных исследований, сравнивающих эффективность, стоимость и кривую обучения ЭА с ОА и эндоскопическими методами энуклеации.
ЛИТЕРАТУРА
1. Gravas S, Bach T, Bachmann A, Drake M, Gacci M, Gratzke C, et al. Treatment of Non-neurogenic Male LUTS. availible from: http:// uroweb.org/guideline/treatment-of-non-neurogenic-male-luts/. Published in 2016.
2. Mariano MB, Graziottin TM, Tefilli MV. Laparoscopic prostatectomy with vascular control for benign prostatic hyperplasia. Urol 2002;167(6): 2528-2529.
3. Sotelo R, Clavijo R, Carmona O, Garcia A, Banda E, Miranda M, et al. Robotic simple prostatectomy. J Urol 2008;179(2):513-515.
4. Lucca I, Shariat SF, Hofbauer SL, Klatte T. Outcomes of minimally invasive simple prostatectomy for benign prostatic hyperplasia: a systematic review and meta-analysis. World J Urol 2015;33(4):563-570.
5. Autorino R, Zargar H, Mariano MB, Sanchez-Salas R, Sotelo RJ, Chlosta PL, et al. Outcomes of robotic and laparoscopic simple prostatectomy: a European-American multi-institutional analysis. Eur Urol 2015;68(1): 86-94.
6. Pokorny M, Novara G, Geurts N, Dovey Z, De Groote R, Ploumidis A, et al. Robot-assisted simple prostatectomy for treatment of lower urinary tract symptoms secondary to benign prostatic enlargement: surgical technique and outcomes in a high-volume robotic centre. Eur Urol 2015;68(3):451-457.









Комментарии