Серегин А.В., Индароков Т.Р., Шустицкий Н.А., Серегин А.А.
Сведения об авторах:
- Серегин А.В. – д.м.н., профессор кафедры урологии и хирургической андрологии РМАНПО, заслуженный врач Российской федерации, заведующий 41 урологическим отделением ГКБ им. С.П. Боткина; Москва, Россия; РИНЦ AuthorID 750126.
- Индароков Т.Р. – научный сотрудник кафедры урологии и хирургической андрологии РМАНПО; Москва, Россия; РИНЦ AuthorID 918559
- Шустицкий Н.А. – к.м.н., врач 41 урологического отделения ГКБ им. С.П. Боткина; Москва, Россия; РИНЦ AuthorID 990130
- Серегин А.А. – доцент кафедры урологии и хирургической андрологии РМАНПО; Москва, Россия; РИНЦ AuthorID 198395
ВВЕДЕНИЕ
Одной из самых актуальных проблем современной онкоурологии является радикальность лечения злокачественных опухолей почек. Оперативное лечение остается в настоящее время основным методом лечения почечно-клеточного рака (ПКР). С течением времени с появлением новых современных методов диагностики и, соответственно, с выявлением все большего количества локализованных форм рака почки возникла необходимость в пересмотре подходов к оперативному лечению и расширении показаний к выполнению органосохраняющего лечения ПКР [1].
После выполнения радикальной нефрэктомии существенно возрастает риск возникновения хронической почечной недостаточности, а также других осложнений со стороны сердечно сосудистой системы [2-5]. Выбор резекции почки при локализованных формах ПКР представляется оправданным, особенно когда речь идет о перспективах дальнейшей жизни пациента. Остающаяся после нефрэктомии единственная почка в силу природных регенеративных способностей при отсутствии в ней патологических процессов в состоянии обеспечить выполнение основных функций поддержания гомеостаза [6]. Тем не менее даже исходно здоровая единственная почка в процессе жизни индивидуума способна поражаться различными болезнями, ведущими к нарушению ее основных функций. Поэтому пациент с единственной почкой не может рассматриваться как абсолютно здоровый, даже при условии радикального удаления опухоли в противоположном органе [7].
Несмотря на совершенствование и разработку различных оперативных и абляционых методик лечения рака почки остается открытым вопрос о функциональном состоянии почки после оперативного лечения [8-13]. Наряду с достижением онкологических результатов сохранение почечной функции является основной задачей в лечении опухолевых заболеваний почек [14, 15]. Компенсаторные возможности почечной паренхимы зачастую играют негативную роль при снижении функции почки. Интенсивный характер противоопухолевого лечения как хирургического, так и консервативного приводит к истощению почечной функции, которая не всегда выявляется при применении рутинных методов диагностики [16]. Исследования последних десятилетий показывают, что хронические заболевания почек (ХЗП) распространены намного больше, чем это считалось ранее. По данным ряда авторов частота нефрологических осложнений при оперативном лечении онкологического процесса в почках достигает от 5–20% до 40–60% и даже, в некоторых случаях 80% [17, 18].
В связи с изложенным возникает необходимость в дополнительном обследовании пациентов, направленном на оценку почечной функции как в до-, так и в послеоперационном периоде [19, 20]. Одним из таких методов является динамическая нефросцинтиграфия (ДНСГ), которая в нашем исследовании была проведена всем пациентам.
Целью исследования явилось изучение с использованием ДНСГ функциональных результатов органосохраняющих операций с применением превентивного шва без пережатия почечной ножки, а также на фоне пережатия почечной ножки.
МАТЕРИАЛЫ И МЕТОДЫ
В основу работы положен анализ результатов обследования и лечения 150 больных с раком почки в стадиях pT1a-Т2аN0M0, в том числе с кистозными формами, которым в период с 2013 по 2017 гг. была выполнена резекция почки с применением превентивного шва без пережатия почечной ножки, а так же 25 пациентов, оперированных в тот же период со стадиями pT1a-Т2аN0M0, которым была выполнена резекция почки с тепловой ишемией. По данным послеоперационного гистологического исследования у всех пациентов были выявлены злокачественные опухоли почек.
У 64 (42,6%) пациентов первой группы опухоль располагалась в среднем сегменте, опухоль верхнего сегмента выявлена у 45 (30%) пациентов и у 41 (27,4%) пациента опухоль располагалась в нижнем сегменте, что представлено на рисунке 1.
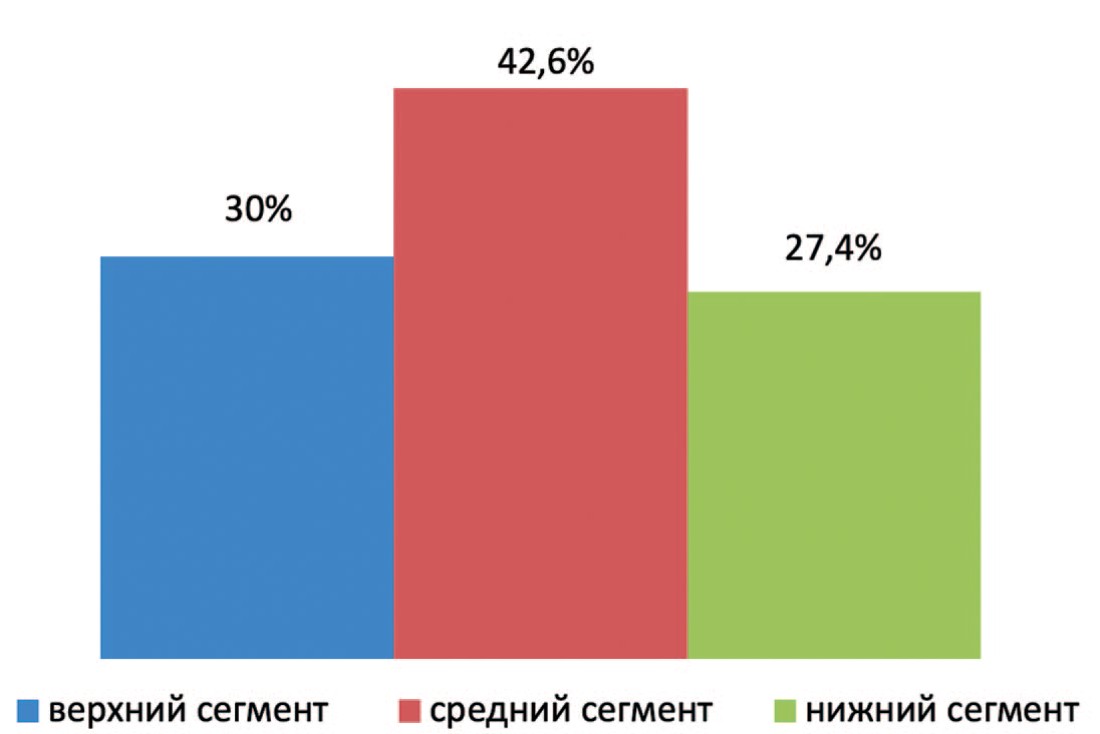
Рис. 1. Частота расположения опухолей в сегментах почки в первой группе
Fig. 1. Location of tumors in kidney segments in the 1-st group
Во второй группе, также как в первой, у большей части пациентов опухолевый узел располагался в среднем сегменте – 10 (40%) человек, в верхнем сегменте – у 7 (28%) пациентов, и – у 8 (32%) пациентов в нижнем сегменте (рис. 2).
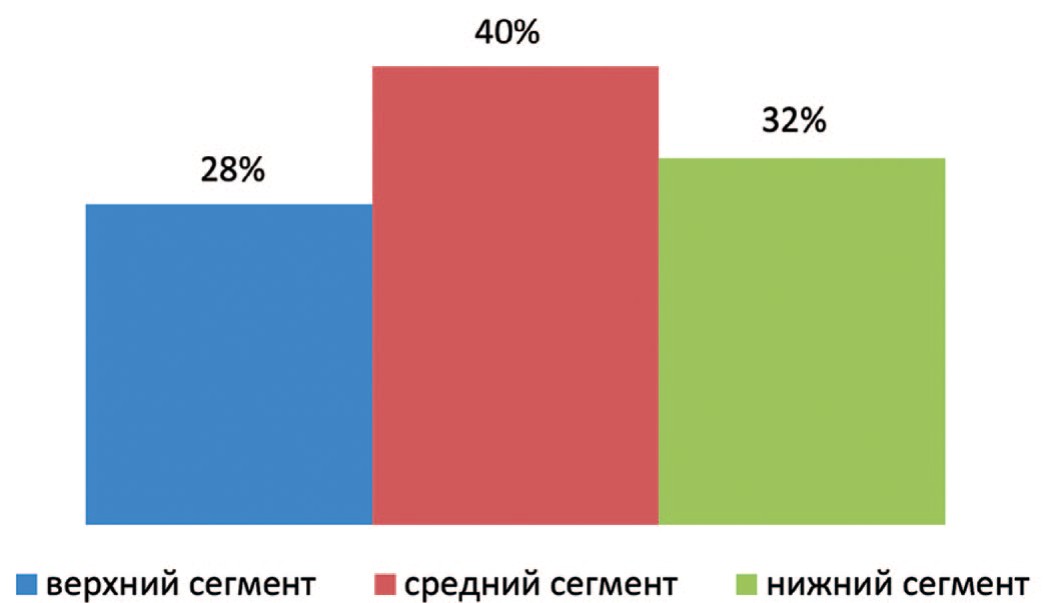
Рис. 2. Расположение опухолей по сегментам почки в группе сравнения
Fig. 2. Location of tumors by segment of the kidney in the comparison group
По стадиям опухолевого процесса пациенты в первой группе разделились следующим образом: стадия T1a была установлена у 74 пациентов, стадия T1b – у 53, стадия T2a – у 4-х. Также в наше исследование вошли 19 пациентов с кистозными опухолями почек (pT1). По абсолютным показаниям резекция почки выполнена 7,8% пациентам, по относительным – 91,2%. Во второй группе пациенты по стадиям распределились следующим образом: стадия T1a была установлена 16 пациентам, стадия T1b – 8, стадия T2a – 1 пациенту. В этой группе пациентов с кистозными опухолями почек не было.
С целью определения сложности предстоящей операции по данным компьютерной томографии (КТ) с контрастным усилением, нами была использована нефрометрическая шкала R.E.N.A.L. Согласно данным этой шкалы пациенты в обеих группах исследования были распределены на 3 группы риска: низкая группа тяжести – в первой группе 78 пациентов, во второй – 18; средняя группа тяжести – в первой 53 пациента, во второй – 6; а тяжелая группа – в первой 19 пациентов, во второй – всего лишь 1.
Основным методом, с помощью которого производилась оценка почечной функции в нашем исследовании, была ДНСГ. Радионуклидные методы исследования почек in vivo в большинстве онкологических клиниках не входят в протокол обязательного скринингового исследования и используются только в качестве вспомогательных методов, однако в разработанном нами алгоритме оценки почечной функции ДНСГ является одним из основных.
Основными показателями для оценки функции пораженной почки были следующие: перфузионный индекс (ПИ), ренальный индекс (РИ) до операции, скорость клубочковой фильтрации (СКФ), время максимального накопления радиофармпрепарата (РФП) в паренхиме (Tmax), средняя площадь функционирующей паренхимы. Расчет показателей проводился с помощью ДНСГ с непрямой изотопной ангиографией до операции и через 1 месяц после оперативного лечения. ДНСГ выполнялась на гаммакамере Infinia Hawkeye 4 GE по стандартной методике с использованием РФП – Тс99m – ДТПА (пентатех, ОАО «Диамед») 370 Мбк внутривенно болюсно. Проводилась визуальная оценка распределения РФП на паренхиматозной и сосудистой фазе исследования. На рисунке 3 представлен результат ДНСГ с дефектом накопления в проекции среднего полюса правой почки, выявленный в паренхиматозной фазе исследования, обусловленного опухолью.
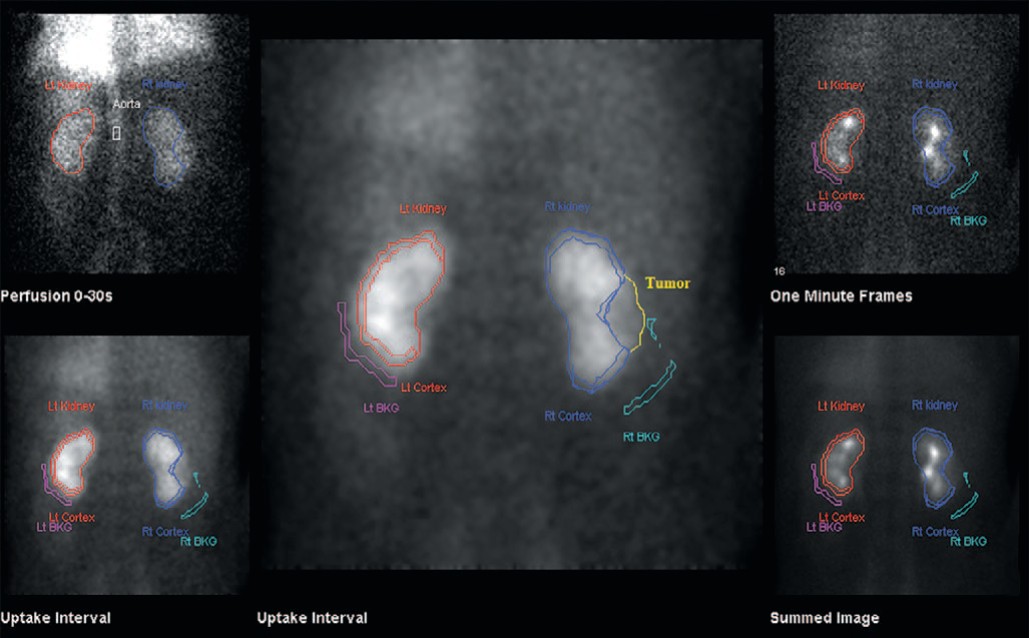
Рис. 3. Динамическая нефросцинтиграфия. Опухоль среднего сегмента левой почки
Fig. 3. Dynamic nephroscintigraphy. Tumor of the middle segment of the left kidney
Статистический анализ не проводился. В исследовании приведены данные дополнительных обследований, проведенных всем пациентам, не требующих проведения статистического анализа.
РЕЗУЛЬТАТЫ
Всем 175 пациентам выполнены органосохраняющие операции. Средняя продолжительность оперативного лечения и объем средней кровопотери в обеих группах была одинаковой, и составили 130±40 мин. и 250±70 мл, соответственно. В первой группе пациентов не проводилось пережатия почечной ножки ни в одном случае. Среднее время тепловой ишемии во второй группе составило 13±2 мин. Результаты оперативного вмешательства представлены в таблице 1.
Таблица 1. Результаты оперативного лечения
Table 1. Results of surgical treatment
| Показатель Index |
Группа 1 group 2 |
Группа 2 group 2 |
|---|---|---|
| Продолжительность операции, мин. Duration of surgery,min |
120±40 | 1250±35 |
| Среднее время общей анестезии, мин. Average time of general anesthesia, min |
130,5±15 | 130,7±11 |
| Средний объем кровопотери, мл. Average blood loss, ml |
170±70 | 110±80 |
| Средний уровень гемоглобина, г/л Average hemoglobin level, g/l |
114±10 | 110±10 |
| Средний уровень креатинина, мкмоль/л Average creatinine levels, mmol/l |
86±15 | 93±10 |
| Средний уровень мочевины, мкмоль/л Average level of urea, mmol/l |
5,4±2 | 6,0±2,5 |
| Время ишемии Ischemia time |
0 | 13±2 |
Всем пациентам в до– и послеоперационном периоде проводилось лабораторное обследование, в том числе определение уровня креатинина и мочевины. При этом достоверно значимых различий по лабораторным показателям в обеих группах выявлено не было, что свидетельствует о необходимости определения функции почки в послеоперационном периоде не только по данным лабораторного обследования.
Через 1 месяц после оперативного вмешательства всем пациентам была выполнена динамическая сцинтиграфия. У больных первой группы отмечено незначительное снижение основных показателей функционального вклада и перфузии пораженной почки: ПИ составил 45,23±3% (до операции 54,13±2), РИ – 44,82±2,39% (до операции 53,24±4), СКФ – 25,84±1,7 мл/мин (до операции 33,84±2), что не выходит за пределы допустимых различий, связанных с ослаблением гамма-излучения Тс99m в мягких тканях при различной глубине залегания РФП в почках. Время максимального накопления РФП в среднем составило 3,6±1,5 мин. (до операции 3,3±1). Данные показатели также находятся в пределах нормальных значений. У пациентов второй группы отмечены более низкие значения показателей, что связанно с тепловой ишемией: ПИ составил – 35,5±3,3% (до операции 48±2,5%), РИ – 39,1±1,4% (до операции 46,3±26%), при этом отмечено снижение более чем на 10 единиц СКФ – до операции средний показатель составлял 36 мл/мин, после операции 22 мл/мин. Уровень суммарной СКФ до операции составлял 79,3 мл/мин, однако через 1 месяц после оперативного лечения выявлено значительное снижение СКФ до 47 мл/мин (рис. 4).
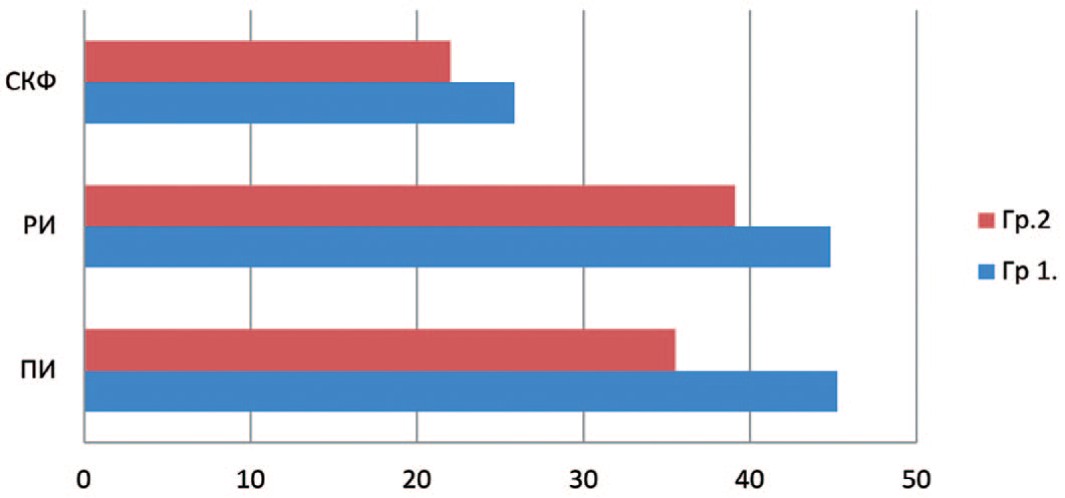
Рис. 4. Функциональное состояние почек в послеоперационном периоде у больных сравниваемых групп
Fig. 4. The functional state of the kidneys in the postoperative period in patients of the compared groups
С целью визуальной оценки изменений в площади почечной паренхиме, ниже представлены рисунки, которые в процентом соотношении показывают изменения в почечной паренхиме без ишемии с использованием нашей методики, и даже с кратковременной ишемией, по отношению к здоровой почке. Одним из основных показателей, заслуживающих внимания, является площадь функционирующей паренхимы (ПФП), которая оценивалась по данным ДНСГ в до- и послеоперационном периоде. Средняя площадь функционирующей паренхимы в первой группе до операции составила 53±10%, а после операции 52±10% (рис. 5).
Во второй группе отмечено выраженное снижение ПФП по сравнению с дооперационными показателями: 55±7%, против 35±9%. При этом обращает на себя внимание выраженное увеличение ПФП до 65±5см2, что свидетельствует о ее гиперфункции (рис. 6).
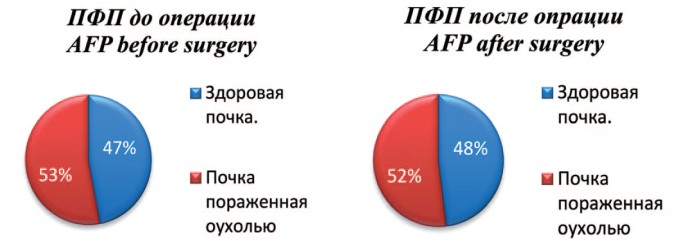
Рис. 5. Соотношение площади паренхимы здоровой и оперированной почек до и после оперативного лечения в 1 группе
Fig. 5. The ratio of the parenchyma area of healthy and operated kidneys before and after surgical treatment in group 1
Во второй группе отмечено выраженное снижение ПФП по сравнению с дооперационными показателями: 55±7%, против 35±9%. При этом обращает на себя внимание выраженное увеличение ПФП до 65±5см2, что свидетельствует о ее гиперфункции (рис. 6).
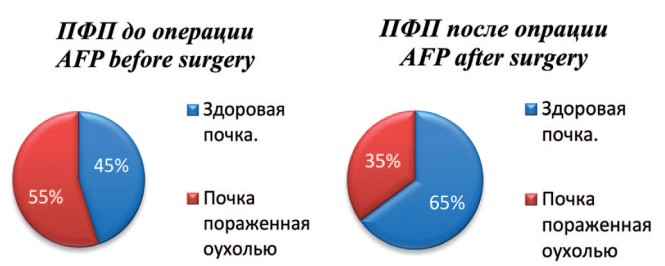
Рис. 6. Соотношение площади паренхимы здоровой и оперированной почек до и после оперативного лечения в группе сравнения
Fig. 6. The ratio of the parenchyma area of healthy and operated kidneys before and after surgery in the comparison group
ВЫВОДЫ
Даже кратковременная ишемия во время выполнения органосохраняющих операций ведет к значительному снижению функции почки, пораженной опухолью. При этом далеко не всегда стандартные лабораторные методы (определение уровня креатинина, мочевины и клиренса креатинина) позволяют в послеоперационном периоде вовремя диагностировать нарушения их функции. Таким образом, на наш взгляд проведенное исследование демонстрирует необходимость в дополнительном обследовании – динамической нефросцинтиграфии, которая позволяет оценить функциональный вклад именно оперированной почки у больных в послеоперационном периоде.
ЛИТЕРАТУРА
- Huang WC, Levey AS, Serio AM. Chronic kidney disease after nephrectomy in patients with renal cortical tumors: a retrospective cohort stady. Lancet Oncologi 2006;7(9):735-740.
- Коган М.И., Гусев А.А., Евсеев С.В. Оценка почечной функции у больных почечно-клеточным раком до и после радикальной нефрэктомии. Онкоурология 2011;7(4):16-20. [Kogan M.I., Gusev A.A., Evseyev S.V. Evaluation of renal function in patients with renal cell carcinoma before and after radical nephrectomy. Cancer Urology = Onkourologiya 2011;7(4):16-20. (In Russian)]. https://doi.org/10.17650/1726-9776-2011-7-4-16-20
- Capitanio U, Terrone C, Antonelli A, Minervini A, Volpe A, Furlan M. Nephron sparing Techniques Independently Decrease the Risk of Cardiovascular Events Relative to Radical Nephrectomy in Patients with a T1a–T1b Renal Mass and Normal Preoperative Renal Function. Eur Urol 2015;67(4):683-689.
- Singer EA, Gupta NG, Bratslavsky G. Partial Nephrectomy for the Treatment of Renal Masses: Oncologically Sound and Functionally Prudent. Renal Cell Carcinoma 2017;51-66.
- Scosyrev E, Messing EM, Sylvester R, Campbell S, Poppel HV. Renal function after nephron-sparing surgery versus radical nephrectomy: results from EORTC randomized trial 30904. Euro Urol 2014;65(2):372-377. https://doi.org/10.1016/ j.eururo.2013.06.044.
- Волкова М.И., Скворцов И.Я., Климов А.В., Черняев В.А., Комаров М.И., Матвеев В.Б., Петерс М.В. Влияние объема хирургического вмешательства на функциональные результаты и кардиоспецифическую выживаемость у больных клинически локализованным раком почки. Онкоурология 2014;10(3):22-30. [Volkova M.I., Skvortsov I.Y., Klimov A.V., Chernyaev V.A., Komarov M.I., Matveev V.B., Peters M.V. Impact of surgical volume on functional results and cardiospecific survival rates in patients with clinically localized renal cancer. Onkourologiya=Cancer Urology 2014;10(3):22- 30. (In Russian)]. https://doi.org/10.17650/1726-9776-2014-10-3-22-30/
- Иванов А.П. Клинико-экспериментальные обоснования органосохраняющих операций при раке почки. [Автореф...дис. д.м.н. М: 2012, 66с.] [Ivanov A.P. Clinical and experimental substantiation of organ-preserving operations in kidney cancer [...Dr. Med. Sci. [thesis]. М: 2012, 66 р.2012. (In Russian)].
- Wu SD, Viprakasit DP, Cashy J, Smith ND, Perry KT, Nadler RB. Radiofrequency Ablation–Assisted Robotic Laparoscopic Partial Nephrectomy Without Renal Hilar Vessel Clamping Versus Laparoscopic Partial Nephrectomy: A Comparison of Perioperative Outcomes. J Еndourol 2010;24(3):385-91. https://doi.org/10.1089/end.2009.0199
- Коган М.И., Гусев А.А., Евсеев С.В. Оценка почечной функции у больных почечно-клеточным раком до и после радикальной нефрэктомии. Онкоурология 2011;7(4):16-20. [Kogan M.I., Gusev A.A., Evseyev S.V. Evaluation of renal function in patients with renal cell carcinoma before and after radical nephrectomy. Onkourologiya=Cancer Urology 2011;7(4):16-20. (In Russian)] https://doi.org/10.17650/1726-9776-2011-7-4-16-20
- Thompson RH, Lane BR, Lohse CM, Leibovich BC, Fergany A, Frank I, Gill IS, Blute ML, Campbell SC. Every minute counts when the renal hilum is clamped during partial nephrectomy. Euro Urol 2010;58(3):340-345. https://doi.org/10.1016/j.eururo.2010.05.047.
- Lane BR, Demirjian S, Derweesh IH, Takagi T, Zhang Z, Velet L, Ercole CE, Fergany AF, Campbell SC. Survival and Functional Stability in Chronic Kidney Disease Due to Surgical Removal of Nephrons: Importance of the New Baseline Glomerular Filtration Rate. Euro Urol 2015;68(6):996-1003. https://doi.org/10.1016/ j.eururo.2015.04.043.
- Zhang С, Zhao X, Guo S, Ji С, Wang W, Guo H. Perioperative outcomes of zero ischemia radiofrequency ablation-assisted tumor enucleation for renal cell carcinoma: results of 182 patients. BMC Urol 2018;18(1):41. https://doi.org/10.1186/s12894-018-0356-1.
- Ng CK, Gill IS, Patil MB, Hung AJ, Berger AK, de Castro Abreu AL. Anatomic Renal Artery Branch Microdissection to Facilitate Zero-Ischemia Partial Nephrectomy. Euro Urol 2012;61(1):67-74. https://doi.org/10.1016/ j.eururo.2011.08.040.
- Boga MS, Sönmez MG. Long-term renal function following zero ischemia partial nephrectomy. Res Rep Urol 2019;11:43-52. https://doi.org/10.2147/ RRU.S174996.
- Hou W, Ji Z. Achieving zero ischemia in minimally invasive partial nephrectomy surgery. Inter J Surg 2015;18:48-54. https://doi.org/10.1016/ j.ijsu.2015.04.046.
- Гусев А.А., Евсеев С.В., Коган М.И. Оценка почечных функций и оперативное лечение почечно-клеточного рака. Онкоурология 2013;9(1):17-23. [Gusev A.A., Evseev S.V., Kogan M.I. Evaluation of renal functions and surgical treatment for renal cell carcinoma. Onkourologiya=Cancer Urology 2013;9(1):17-23. (In Russian)]. https://doi.org/10.17650/1726-9776-2013-9-1-17-23.
- Давыдов М.И. Долгушин Б.И. Радионуклидные исследования функции почек и уродинамики в онкологии. Практическая медицина, 2007, 296 с. [Davydov M.I. Dolgushin B.I. Radionuclide studies of renal function and urodynamics in oncology. Practical Medicine, 2007, 296 p. (In Russian)].
- Becker F, Poppel HV, Hakenberg OW, Stief C, Gill I, Guazzoni G, Montorsi F, Russo P, Stöckle M. Assessing the impact of ischaemia time during partial nephrectomy. Euro Urol 2009;56(4):625-635. https://doi.org/10.1016/j.eururo.2009.07.016.
- Kwon T, Jeong IG, Ryu J, Lee C, Lee C, You D, Kim CS. Renal Function is Associated with Nephrometry Score After Partial Nephrectomy: A Study Using Diethylene Triamine Penta-Acetic Acid (DTPA) Renal Scanning. Annal Surg Oncol 2015;22:1594-1600.
- Khalifeh A, Autorino R, Hillyer SP, Kaouk JH. V-Hilar Suture Renorrhaphy During Robotic Partial Nephrectomy for Renal Hilar Tumors: Preliminary Outcomes of a Novel Surgical Technique. Urology 2012;80(2):466-473. https://doi.org/10.1016/j.urology.2012.03.058.









Комментарии