Garolla А., Muscianisi F., Engl B., Menegazzo M., Pizzol D., Cosci I., Ghezzi M., Foresta C.
Сведения об авторах:
- Andrea Garolla - Professor, Unit of Andrology and Reproductive Medicine, Department of Medicine, University of Padova Via Gabelli 63 - 35121 Padova, Italy.
- Muscianisi, B. Engl, M. Menegazzo, D. Pizzol, I. Cosci, M. Ghezzi, C. Foresta – сотрудники Department of Medicine, University of Padova Via Gabelli 63 - 35121 Padova, Italy
DOI: 10.29188/2222-8543-2020-12-3-110-117
ВВЕДЕНИЕ
Вирус папилломы человека (ВПЧ) на данный момент является важным фактором, ответственным за развитие рака и бесплодия, как у мужчин, так и у женщин [1, 2]. При ВПЧ-инфекции у мужчин данный вирус обнаруживается не только в мочеполовом тракте в целом, но даже в эякуляте и может связывать сперматозоиды [3]. Обнаружение ДНК ВПЧ в сперматозоиде демонстрирует связь со снижением подвижности сперматозоидов и с выработкой антиспермальных антител [4, 5]. Новый взгляд на репродуктивное здоровье подтверждает роль ВПЧ в формировании бесплодия в паре. При естественном зачатии частота спонтанных абортов и сложных врожденных дефектов у пар, инфицированных ВПЧ, представляется спорной и требует подтверждения в тщательных исследованиях [6]. Клинические исследования, в которых приняли участие женщины с ВПЧ в цервикальном канале, которым была выполнена та или иная вспомогательная репродуктивная технология (ВРТ), показали значительное снижение частоты беременностей в сравнении с неинфицированными [7]. Хотя возможные последствия влияния ВПЧ на плод точно не установлены, в эксперименте in vitro было показано, что инфицирование ВПЧ клетки трофобласта повышает вероятность задержки созревания на определенной стадии, апоптоза и ухудшение инвазии трофобласта в стенку матки по сравнению с контрольной группой [8]. Мы провели исследование, используя тест с пенетрацией яйцеклетки хомячка (HEPT), инфицированной и неинфицированной человеческой спермой. HEPT показал, что сперма человека, инфицированная ВПЧ, была способна проникнуть в ооцит хомяка, даже если число пенетраций на 1 ооцит было ниже, чем в контрольной группе. Более того, ооциты, пенетрированные инфицированной спермой, воспроизводили вирусные гены, что говорит об активной транскрипции вирусных генов в инфицированных ооцитах. Несмотря на высокую значимость этих данных, неизвестно могут ли полученные результаты in vitro, быть применимы in vivo [9]. Другое исследование, изучающее роль ВПЧ у бесплодных пар, прошедших через циклы ВРТ, показало снижение частоты наступления беременностей и повышение частоты спонтанных абортов в парах с ВПЧ инфекцией в сравнении с неинфицированными парами. Риск был выше, когда ДНК ВПЧ при тестировании была выявлена у женщин, и был еще выше при нахождении ДНК ВПЧ в сперме [10].
Целью настоящего исследования было оценить распространенность и локализацию ВПЧ в сперме мужчин в бесплодных парах, проходящих лечение в центре репродуктивного здоровья. Более того, мы рассмотрели репродуктивные исходы при естественных и при использовании ВРТ беременностях у пар с или без ВПЧ в сперме.
МАТЕРИАЛЫ И МЕТОДЫ
Мы провели проспективное наблюдательное исследование в когорте, состоящей из 250 бесплодных пар, которые не могли зачать ребенка как минимум 2 года и записались на процедуру внутриматочной инсеминации (ВИ) или экстракорпорального оплодотворения (ЭКО) в отделении репродуктивного здоровья человека и отделении криоконсервации гамет человека клиники акушерства и гинекологии в Bruneck Hospital между январем 2013 и декабрем 2014. Во время набора испытуемой группы все пациенты были информированы в полном объеме о цели исследования и включались в группу только при наличии письменного согласия на исследование и использование их персональных данных в соответствии с законодательством Италии. Данная работа была одобрена Экспертным советом нашего госпиталя, протокол № 2336Р. Мы считали правомерным включить в исследование женщин с нормальным овуляторным циклом, т.к. согласно Болонским критериям их сочли подходящими респондентами как страдающих идиопатическим/необъяснимым бесплодием в возрасте 25 – 35 лет, с отрицательным ПАП – тестом и на наличие Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis, бактериального вагиноза [11]. Мы исключили пациентов с оперативными вмешательствами на яичниках/маточных трубах в анамнезе, пациентов с дисплазией шейки матки в анамнезе, эндометриозом, воспалительными заболеваниями органов малого таза, окклюзией маточных труб и синдромом поликистозных яичников. В дополнении, мы исключили пациентов получавших лечение по поводу доброкачественных заболеваний матки (например, полип эндометрия, субмукозная миома, внутриматочными синехиями/внутриматочными перегородками) за 6 месяцев до ВИ/инъекции сперматозоида в цитоплазму ооцита (ИКСИ). Пациенты с курением, аномалиями кариотипа, мутациями в гене кистозного фиброза, сложными системными болезнями (сахарный диабет, рассеянный склероз, заболеваниями надпочечников, дисфункцией щитовидной железы, изменениями базального уровня пролактина в сыворотке крови, гипо- и гипергонадотропным гипогонадизмом, приобретенными или наследственными тромбофилиями и иммунологическими нарушениями), с новообразованиями, с химио/лучевой терапией, непролеченными заболеваниями матки (полипы, миомы, синехии и перегородки) в анамнезе также были исключены.
В исследование включили мужчин из бесплодных пар в возрасте от 25 до 40 лет с нормальными или измененными параметрами эякулята, согласно руководству ВОЗ 2010 года, и исключили пациентов с астенозооспермией [12]. Также были исключены пациентов с выявленной инфекцией в сперме (Chlamydia trachomatis, Ureoplasma, Neisseria gonorrhoae и другими инфекциями, положительными результатами серологического анализа к ВИЧ 1 и 2 типов, Т-клеточным лимфотропным вирусом человека 1 и 2 типов, вирусными гепатитами B и С, сифилисом). Пациенты с генетическими мутациями, аномалиями кариотипа, микроделециями Y хромосомы или мутациями CFTR были также исключены. Каждый мужчина из пары был обследован методом флуоресцентной гибридизацией in situ (FISH – метод) для определения ВПЧ в сперматозоидах и слущенных клетках эпителия при наборе группы и в день ВИ/ИКСИ.
Получение образцов спермы
Образцы спермы были получены путем мастурбации пациентов после 3 дней сексуального воздержания. После разжижения спермы при комнатной температуре были определены качественные показатели образцов: объем, pH, концентрация сперматозоидов, жизнеспособность, подвижность и морфология согласно гайдлайну ВОЗ [12]. Каждый образец тестировался при помощи МАР-теста для определения антиспермальных антител.
Определение антиспермальных антител
Антиспермальные антитела определялись методом МАР-теста для выявления IgG и IgA (FertiPro N.V., Sint-Martens-Latem, Belgium). Образцы спермы были обработаны согласно протоколу исследования. Тест считался положительным, когда сперматозоиды были частично или полностью покрыты частицами латекса. Реакционная способность теста была подтверждена последующим образованием агглютинатов к самим частицам латекса. Напротив, свободно движущиеся сперматозоиды, не покрытые частицами латекса, считались отрицательными.
FISH-метод для определения ВПЧ
Данный метод исследования выполнялся при первоначальном обследовании пациентов и в день ВРТ. Предметные стекла, содержащие как минимум 2*106 преципитированных сперматозоидов, фиксировали в растворе метанол-уксусной кислоты в течение 1 часа при температуре -200С. Для обеспечения лучшей проницаемости образцов их расщепляли пепсином, разведенным 1:25000, в предварительно нагретой 0,01 моль/л соляной кислоте в течение 10 минут при 370С. Расщепление образцов пепсином останавливали 3 – 5 минутным промыванием в натрий-фосфатном буфере (PBS); затем образцы были обезвожены в 70%, 80% и 95% растворах этилового спирта в течение 2 минут и затем уже высушивались на воздухе. Образцы обрабатывались 20 мл гибридизационного раствора (Pan Path), содержащего меченный биотином ДНК-зонд вируса папилломы человека (смесь общих генов, содержащих консервативный регион ВПЧ). Каждое предметное стекло покрывалось еще одним, а края замазывались лаком для ногтей во избежание потери смеси во время денатурации и гибридизации. После одновременной денатурации клеточного ДНК и ДНК-зонда ВПЧ в нагревательном блоке в течение 5 минут при 950С, осуществили гибридизацию путем инкубации образцов при 370 С в течение ночи в увлажненной камере. После этого покровное стекло осторожно удалялось, предметное стекло промывалось в натрий-фосфатном буфере в течение 10 минут. После 15 минутной инкубации при 370С дифференцирующим реагентом (Pan Path) предметные стекла трижды промывались в натрий-фосфатном буфере. Биотин-меченный ВПЧ-зонд определяли инкубацией со стрептавидином 1:200 Texas Red (Vector Laboratories) в течение 40 минут при комнатной температуре. После обнаружения меток, предметные стекла дважды промывали в натрий – фосфатном буфере/0,01% Triton и затем дважды в растворе, содержащем DAPI и антиФАД (BioBlue, BioView). Образцы анализировали с использованием флуоресцентного микроскопа (Nikon ViCo video confocal microscope), снабженного набором фильтров (FITC, TRITC, DAPI). На каждом предметном стекле анализировали по меньшей мере 200 сперматозоидов и 200 слущенных эпителиальных клеток. Фиксация сигналов ядерной гибридизации проводилась тремя исследователями. Когда ядра были полностью гомогенно окрашены и появлялись многочисленные мелкие пятна или единичные большие сигналы, сперматозоиды классифицировались как положительные. Метод был протестирован на контрольных предметных стеклах, содержащих клетки клеточной линии рака шейки матки человека CaSki со стабильно интегрированным и транскрипционно активным геномом ВПЧ, которые служили контролем для конкретного зонда. Клетки, нанесенные на обработанное предметное стекло, были фиксированы 4% раствором параформальдегида в натрий-фосфатном буфере в течение 10 минут. После фиксации клетки промывались 3 – 5 минут в натрий-фосфатном буфере и дегидратировались 5 минутным промыванием этанолом (30%, 60%, 95%). Клеточные мазки затем высушивали на воздухе и хранили при температуре 40С до использования.
Дизайн исследования
При включении в исследование пары были разделены на две группы, основываясь на наличии или отсутствии ВПЧ в сперме, и исходах, зарегистрированных после 2 следующих подряд фаз. Первая фаза длилась 6 месяцев (диагностический период), начиная от набора и заканчивая моментом начала проведения ВРТ циклов. Во второй фазе длительностью 12 месяцев (период ВРТ) пары подвергались ВИ/ИКСИ. Первичными конечными точками была распространенность ВПЧ в сперме при использовании метода FISH в период обследования и в день проведения ВРТ; и клиническая беременность в оба периода. В период исследования мы также регистрировали уровень беременностей, выкидышей и здоровых новорожденных. На рисунке 1 показана блок-схема всего исследования.
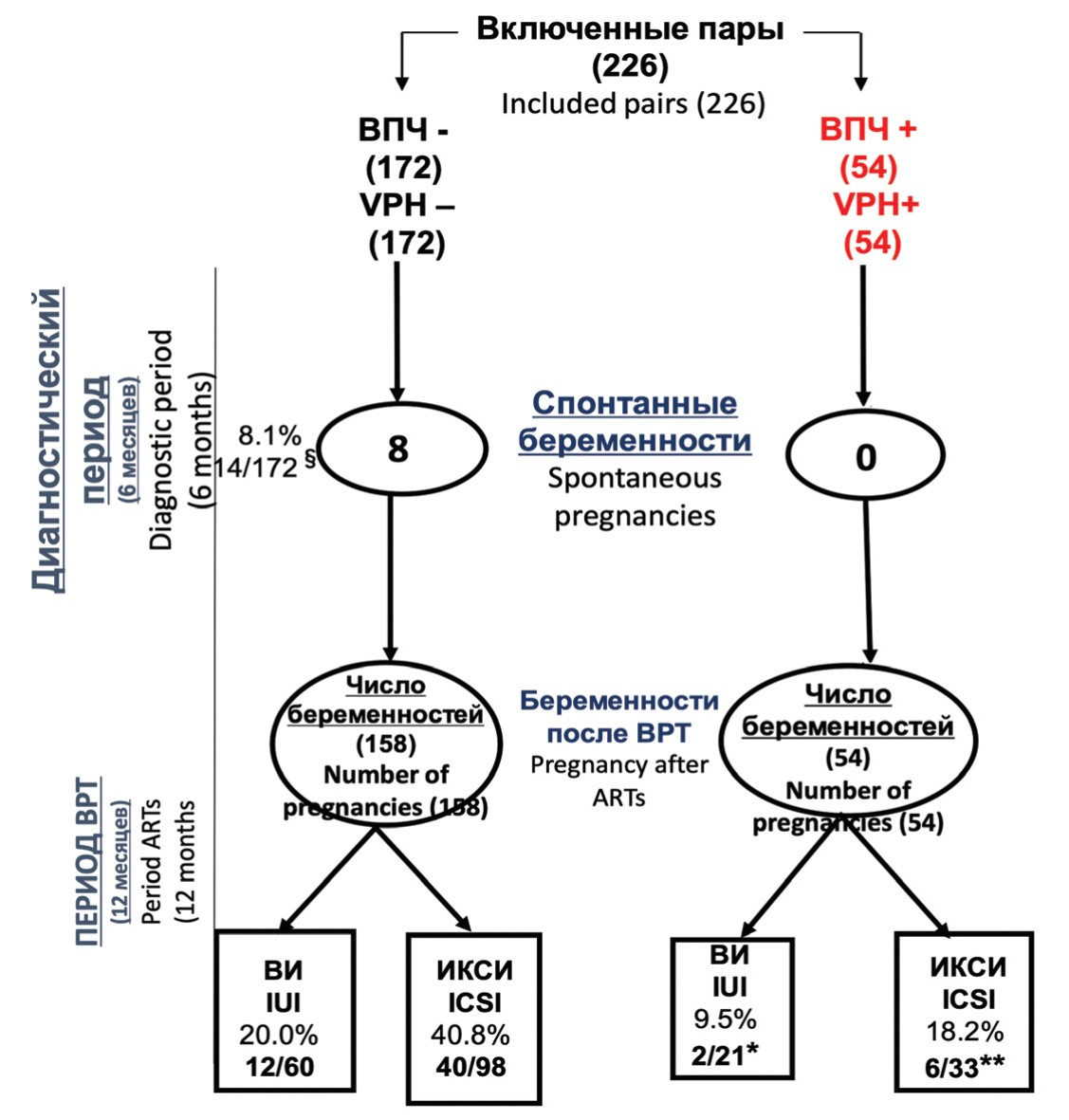
Рис. 1 Блок-схема исследования
Fig. 1. Block diagram of the study
Применение ВРТ
Через 6 месяцев после первого визита все пары, которые еще не достигли спонтанной беременности, поступили на 3 цикла ВИ (ВИ группа) или на один цикл ИКСИ (ИКСИ группа). Если количество подвижных сперматозоидов было не подходящим для ВИ (<5 × 106/мл), пары поступали на ЭКО. Женщины, включенные в ВИ группу, получали дневную дозу в 50 ЕД рекомбинантного фолликустимулирующего гормона (рФСГ) (Puregon, N.V. Organon, BH Oss, Nederland), начиная с третьего дня после окончания менструации. Когда хотя бы один фолликул достигал диаметра 16 мм по результатам трансвагинального УЗИ, мы применяли 10000 ЕД хорионического гонадотропина человека (ХГЧ) для стимуляции овуляции. ВИ проводилась через 36 часов после использования ХГЧ.
Женщины, включенные в группу ИКСИ, получали циклы контролируемой гиперстимуляции яичников (КГЯ) по гибкой схеме протокола короткого антагониста с дневной дозой гонадотропин-рилизинг-гормона (ГнРГ) (0,25 мг/0,5 мл) цетрореликса (Cetrotide, Merck-Serono, Geneva, Switzerland), начиная с обнаружения хотя бы одного фолликула в диаметре больше 14 мм по данным трансвагинального УЗИ и продолжая до применения ХГЧ (гибкий протокол). Все женщины также получали лечение рекомбинантным фолликулостимулирующим гормоном (rFSH, Gonal-F, Merck-Serono, Geneva, Switzerland) с начальной дозы (предназначенной для первых 5 дней) 150 МЕ, принимаемой с третьего дня после окончания менструации (ожидаемый базальный эстрадиол <0,3 нмоль/л). Клиницисты определяли последующую дозировку в течение цикла, основываясь на биохимических и ультразвуковых данных овариального ответа.
Всем женщинам мы проводили подкожную инъекцию 10000 ЕД ХГЧ для стимуляции овуляции. Извлечение ооцита проводилось через 36 часов после применения ХГЧ и все ооциты были оплодотворены техникой ИКСИ. После получения одна бластоциста был перенесена через 5 дней после забора (после отбора по качеству).
Все пациентки получали высокую дозу прогестерона (90 мг вагинально) для поддержания лютеиновой фазы до анализа на бета-хорионический гонадотропин человека (β-ХГЧ), который проводился на 14-й день после переноса эмбриона (ПЭ). Клиническая беременность была подтверждена положительным значением β-ХГЧ в сыворотке крови через 2 недели после переноса эмбриона/ВИ.
Всем женщинам были назначены комбинированные оральные контрацептивы (COC, Gestodiol 20®, 20 mgc ethinylestradiol and 75 mcg gestodene) в предшествующие месяцы перед началом КГЯ. Более того, все женщины получали диетические добавки с инозитолом и фолиевой кислотой (Dikirogen, Pizeta Pharma, Perugia, Italia) в течение КГЯ.
Статистический анализ
Результаты представлены в виде среднего + СО (стандартное отклонение), а категориальные переменные выражены в процентах. Сравнения между группами проводились с t-критериями Стьюдента после принятия нормальности с помощью критерия Колмогорова-Смирнова и с помощью критерия кси-квадрат для категориальных данных. Сравнение пропорций проводилось с помощью одностороннего непараметрического критерия повторной выборки. Значения вероятности (p<0,05) считались статистически значимыми.
РЕЗУЛЬТАТЫ
Из 250 наблюдаемых пар 226 завершили весь период исследования и были включены в анализ. Средний возраст при поступлении составил 34,2±4,1 для мужчин и 31,3±3,2 – для женщин. Анализ FISH на ВПЧ, проведенный в образцах спермы партнеров-мужчин, показал 23,9% позитивных результатов (54 из 226 пациентов). Результаты анализа FISH были подтверждены в образцах спермы, используемой для ВРТ. Средний возраст партнеров мужского и женского пола инфицированной и неинфицированной групп существенно не отличались. Мужчины показали присутствие вируса в сперматозоидах и/или слущенных клетках. В частности, у 28 (51,9%) пациентов инфекция была обнаружена в сперматозоидах, у 8 (22,2%) ограничена слущенными клетками и у 14 (25,9%) имелись оба варианта.
На рисунке 2 приведены некоторые примеры анализа FISH на ВПЧ в образцах спермы бесплодных пациентов, выделяя образцы эякулята, подходящие для естественного или вспомогательного оплодотворения. На верхнем рисунке показан отрицательный образец как в отношении спермы, так и в отношении слущенных клеток эпителия, на нижнем - положительный образец для слущенных клеток.
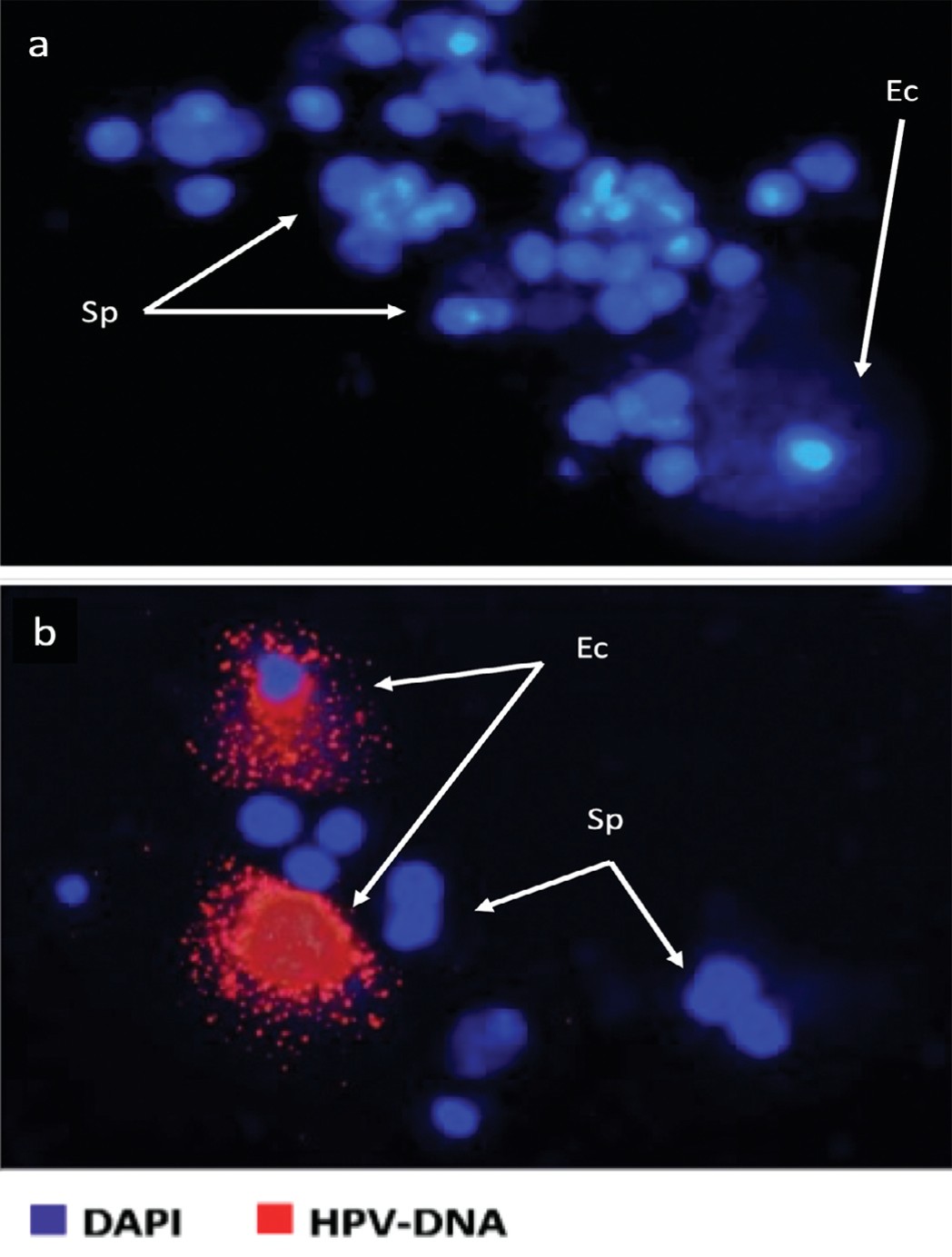
Рис. 2. Результаты анализа FISH на ВПЧ в образцах спермы. Вверху – отрицательный образец в отношении спермы и слущенного эпителия, внизу – положительный результат для слущенного эпителия.
Fig. 2. Results of FISH analysis for HPV in semen samples. The top image - negative for sperm and desquamated epithelium, The bottom image - positive for desquamated epithelium
На рисунке 1 показано течение исследования в виде блок-схемы. В течение периода диагностики (6 месяцев) 14 из 172 (8,1%) пар без ВПЧ в сперме имели спонтанную беременность, в то время как в зараженной группе спонтанных беременностей не было (р = 0,04). В течение периода ВРТ (12 месяцев) у 12 (20%) из 60 пар была успешной ВИ и у 40 (40,8%) из 98 было успешное ИКСИ. В группе инфицированных отмечено 2 (9,5%) из 21 и 6 (18,2%) из 33 успешных попыток ВИ и ИКСИ, соответственно. Среди инфицированных пациентов с успешной ВРТ в обоих случаях ВИ была обнаружена ВПЧ инфекция, ограниченная отшелушенными клетками. Случаи с положительным ИКСИ показали следующую картину: 3 случая при обнаружении ВПЧ в сперматозоидах, один – ограничен отшелушенными клетками и у 2 пациентов ВПЧ был обнаружен в обеих группах клеток.
На рисунке 3 приведены некоторые примеры анализа FISH на ВПЧ в образцах спермы бесплодных пациентов, которые не подходят для естественного или вспомогательного оплодотворения. Верхний рисунок показывает положительный образец спермы. На нижнем – показан положительный образец, как для сперматозоидов и отшелушенных клеток.
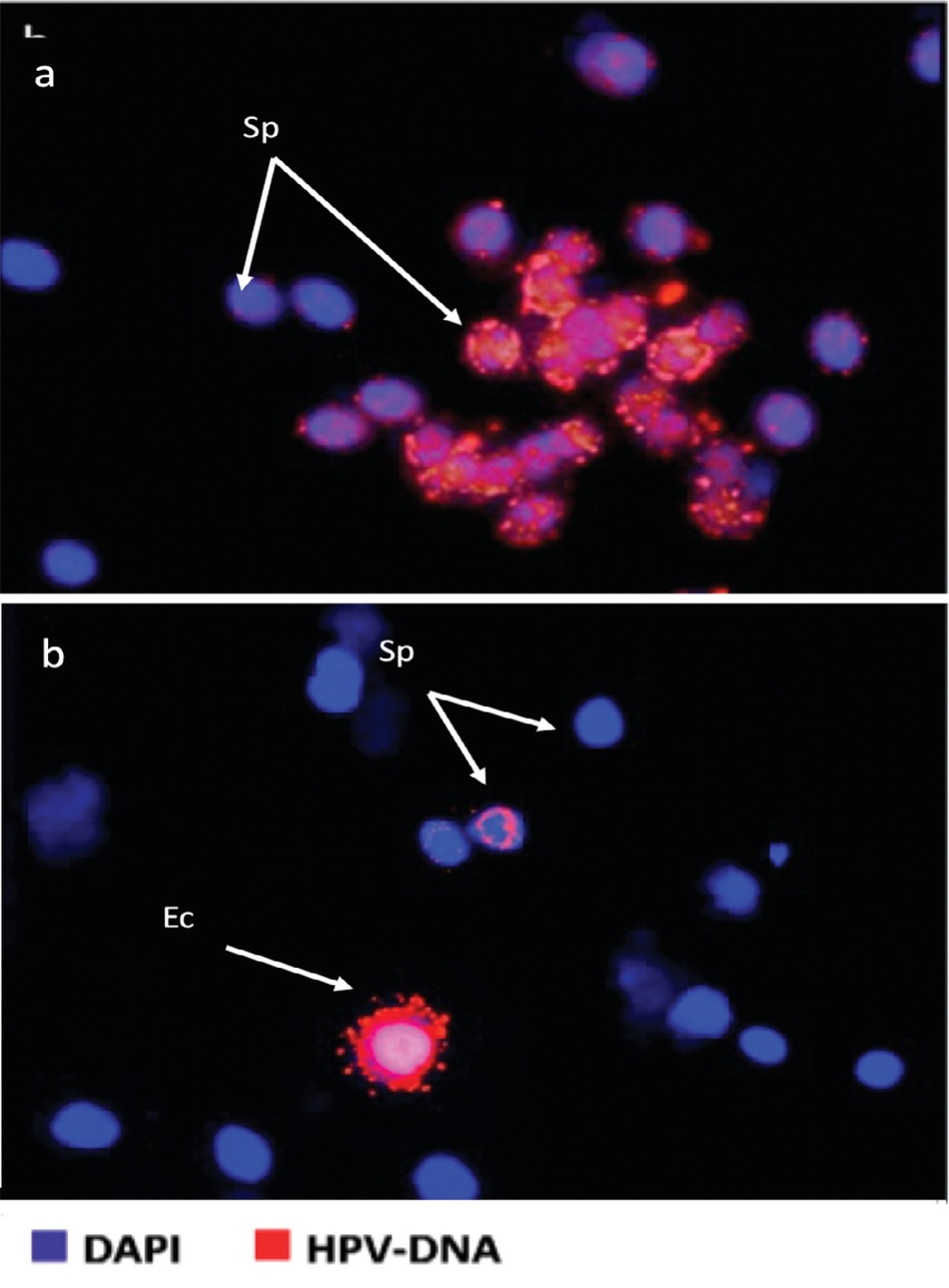
Рис. 3. Результаты анализа FISH на ВПЧ в образцах спермы бесплодных пациентов, которые не подходят для оплодотворения. Верхняя часть показывает положительный образец спермы. На нижней части показан положительный образец, как для сперматозоидов и отшелушенных клеток
Fig. 3. Results of FISH analysis for HPV in sperm samples of infertile patients that are not suitable for fertilization. The top image - shows a positive semen sample. The bottom image - shows a positive sample, both for sperm and exfoliated cells
На рисунке 4 представлены совокупные показатели беременностей и их исходы, наблюдаемые у неинфицированных и инфицированных пар. Совокупные показатели беременности, зарегистрированные у неинфицированных и инфицированных пар, составили соответственно 38,4% и 14,2% (р <0,05). На сегодняшний день из 66 беременностей, зарегистрированных в неинфицированных случаях, 55 родили здоровых детей, а в 11 случаях произошли выкидыши. Из 8 беременностей, зарегистрированных в инфицированной группе, трое родили здоровых детей. В этой группе мы наблюдали значительно более высокую частоту выкидышей (62,5% против 16,7% у неинфицированных (р<0,05). В частности, все потери беременностей в зараженной группе были на ранних сроках (3 – на пятой и 2 – на шестой неделе беременности). Наконец, локализация ВПЧ в эякуляте была различной в случаях родов или выкидышей. В трех случаях, когда родились здоровые дети, инфекция ограничивалась отслоившимся клетками, в то время как пять случаев невынашивания всегда показывали присутствие ВПЧ в сперматозоидах (2 случая – сперматозоиды и отслоившиеся клетки и 3 случая – только сперматозоиды).
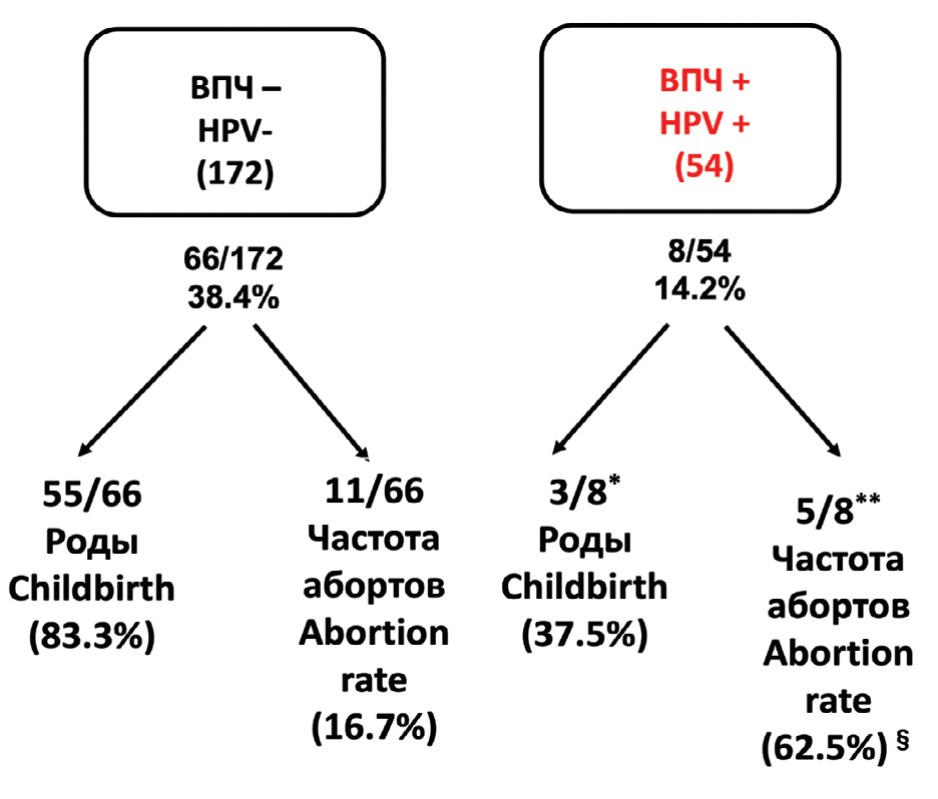
Рис. 4. Сравнение совокупных показателей беременности, живорождений и выкидышей, наблюдаемых у неинфицированных и зараженных пар
Fig. 4. Comparison of cumulative rates of pregnancy, live births and miscarriages observed in uninfected and infected couples
ОБСУЖДЕНИЕ
Возможная причинно-следственная связь между ВПЧ-инфекцией и нарушением фертильности представляет собой одну из самых интересных и обсуждаемых тем в последние годы [10, 13, 14]. Начиная с исследования инфицирования мужской спермы, несколько авторов обнаружили в различных исследованиях более высокую распространенность ВПЧ в сперме у бесплодных мужчин по сравнению со здоровыми [14-17]. Более того, в недавнем литературном обзоре проанализированы все сильные стороны и возможные ошибки исследований по этой теме при общем размере выборки в 1920 пациентов и выявлена сильная связь между ВПЧ-инфекцией в эякуляте и астенозооспермией [13]. Еще один важный вывод, который заслуживает дальнейшего выяснения – это высокая распространенность антиспермальных антител в семенной жидкости у мужчин, инфицированных ВПЧ, что приводит нас к предположению, что снижение подвижности может быть связано с наличием антиспермальных антител на поверхности сперматозоидов [18]. В настоящем исследовании мы, безусловно, подтвердили этот важный результат, сообщая о значительном снижении подвижности сперматозоидов у пациентов с положительным анализом на ВПЧ и наблюдаемой высокой распространенности ВПЧ-инфекции в эякуляте (около 24%) у бесплодных пар, у которых применялись ВРТ. Наши результаты сопоставимы с данными недавнего мета-анализа C. Laprise и соавт., которые сообщили об общей распространенности ВПЧ инфекции сперматозоидов у мужчин, предпринимающих попытки лечения бесплодия приблизительно в 16% по сравнению с 10% среди общего населения [19]. Объединяя эти доказательства, наши данные показывают, что в течение периода диагностики только пары без ВПЧ-инфекции в эякуляте имели спонтанную беременность (8,1%). Кроме того, это первое исследование, которое четко демонстрирует значительное снижение частоты спонтанной беременности в парах без какого-либо известного фактора бесплодия, кроме наличия ВПЧ в эякуляте. Становятся все более убедительными доказательства, что инфицированные сперматозоиды могут действовать как переносчик вирусного генома в ооцит во время зачатия [20]. Последствия этой инфекции могут варьировать от активной вирусной репликации в оплодотворенных ооцитах и клетках трофобласта вплоть до клинически не обнаруживаемых, очень ранних случаев выкидыша [21]. Это представляет серьезную проблему как для массового лечение бесплодия, так и для применения ВРТ. В нашей выборке мы сообщили о значительном снижении частоты успешных исходов ВРТ как при ВИ (от 20% у ВПЧ-отрицательных до 9,5% у ВПЧ-положительных сперматозоидов), так и когорты ИКСИ (от 40,8% у ВПЧотрицательных до 18,2% у ВПЧ-положительных сперматозоидов) со значительным снижением общего количества беременностей (как спонтанных, так и искусственных) во всех ВПЧ-позитивных парах. Основное заключение, которое могло бы объяснить это явление, по нашему мнению – это влияние инфекции ВПЧ, так как неинфицированная и зараженная группа была сопоставимы и однородны по всем сопутствующим факторам. Также очень важно подчеркнуть, что все пациенты с успешным лечением с применением ВИ/ИКСИ и положительными результатами тестов на ВПЧ в эякуляте показали локализацию ВПЧ в слущенных клетках и ни у одного из 5 пациентов с инфицированными сперматозоидами не родились здоровые дети. Это последнее предположение подтверждается недавней статьей, в которой авторы продемонстрировали способность сперматозоидов, инфицированных ВПЧ, оплодотворять ооцит, но со значительно сниженной скоростью проникновения по сравнению с ВПЧ-отрицательными сперматозоидами [9]. Что касается последствий оплодотворения яйцеклетки инфицированными сперматозоидами, здесь очень много информации для дальнейшего изучения. Недавнее исследование показало, что в ооците, инфицированном ВПЧ, происходит активная экспрессия вирусного генома [9]. Кроме того, в различных исследованиях in vitro задокументированы негативные последствия присутствия ВПЧ в клетках бластоцисты и трофобласта [21]. Действительно, скорость апоптотических процессов в ВПЧ-инфицированных клетках трофобласта были значительно выше по сравнению с отрицательным контролем, и это явление было связано с прогрессирующим снижением инвазивной способности трофобласта [22-24]. Наконец, было показано, что ВПЧинфекция эмбрионов может быть связана со значительным уменьшением образования бластоцисты, особенно на 2-клеточной стадии эмбриона. Это наблюдение предполагает, что негативный эффект ВПЧ влияет на раннее развитие эмбрионов [25]. Это доказательство может объяснить наш вывод о значительно более высокой частоте выкидышей, наблюдаемой в парах с ВПЧ-инфекцией сперматозоидов (62,5% против 16,7%) у кандидатов на ВРТ. Наши данные находятся в соответствии с единственным проспективным исследованием, проведенным в этой области, которое сообщило о подобной частоте выкидышей (66,7%) в парах, проходящих курс ВРТ со спермой, инфицированной ВПЧ [10]. Конечно, наши результаты, хотя и находятся в соответствии с данными A. Perino и соавт. [10], но отличаются от иных опубликаций, которые не смогли найти причинно-следственную связь между ВПЧ и спонтанными абортами [26-28]. Однако все эти работы делают выводы, основанные на ряде предположений, и они не учитывают, какие именно клетки в эякуляте были инфицированы, и не оценивали негативное влияние инфицированной спермы на бластоцисты [29].
ВЫВОДЫ
Мы считаем, что следует уделять больше внимания оценке наличия ВПЧ, особенно у мужчин из пар, проходящих лечение при бесплодии. Как указывалось ранее, по предложению нашей исследовательской комиссии было бы полезно проводить тест на ВПЧ и, в случае инфекции, выполнять анализ FISH спермы мужчин с идиопатическим бесплодием или попыткой ВРТ [13, 18, 19]. Насколько нам известно, это первое проспективное исследование, которое демонстрирует как значительное снижение частоты спонтанной и ассистиованной беременности, так и значительное увеличение частоты выкидышей в парах с инфекцией сперматозоидов ВПЧ, при применении ВРТ. Непосредственным выводом в повседневной клинической практике является выявление нового важного фактора мужского бесплодия, который нельзя недооценивать во время оценки идиопатических бесплодных пар, особенно когда все другие известные причины бесплодия исключены. Конечно, наши результаты подтверждаются кратким исследованием, с дизайном, включающим небольшую выборку. Тем не менее, наша выборка является однородной и наши выводы четко показывают значительное ухудшение исхода беременности в случае ВПЧ инфекции в эякуляте. Несмотря на возможные ограничения настоящего исследования, если наши результаты будут подтверждены, то они могут значительно изменить клинический подход к парам, инфицированным ВПЧ. В свете этих представлений обязательно нужно планировать новые клинические и лабораторные исследования, цель которых окончательно подтвердить наши данные и углубить знания о биологическом механизме бесплодия, связанного с ВПЧ.
ЛИТЕРАТУРА
- Schiller JT, Lowy DR. Understanding and learning from the success of prophylactic human papillomavirus vaccines. Nat Rev Microbiol 2012;10(10):681-692. doi: 10.1038/nrmicro2872
- Souho T, Benlemlih M, Bennani B. Human papillomavirus infection and fertility alteration: a systematic review. PLoS One 2015;18,10(5):e0126936. doi: 10.1371/journal.pone.0126936.
- Nielson CM, Flores R, Harris RB, Abrahamsen M, Papenfuss MR, Dunne EF, et al. Human papillomavirus prevalence and type distribution in male anogenital sites and semen. Cancer Epidemiol Biomarkers Prev 2007;16(6):1107-1114. doi: 10.1158/1055-9965.
- Rintala MA, Grenman SE, Pollanen PP, Suominen JJ, Syrjanen SM. Detection of highrisk HPV DNA in semen and its association with the quality of semen. Int J STD AIDS 2004;15(11):740– 743. doi: 10.1258/0956462042395122.
- Garolla A, Pizzol D, Bertoldo A, De Toni L, Barzon L, Foresta C. Association, prevalence, and clearance of human papillomavirus and antisperm antibodies in infected semen samples from infertile patients. Fertil Steril 2013;99(1):125-131. doi: 10.1016/j.fertnstert.2012.09.006
- Dana A, Buchanan KM, Goss MA, Seminack MM, Shields KE, Korn S, et al. Pregnancy outcomes from the pregnancy registry of a human papillomavirus type 6/11/16/18 vaccine. Obstet Gynecol 2009;114(6):1170-8. doi: 10.1097/AOG.0b013e3181c2a122.
- Spandorfer SD, Bongiovanni AM, Fasioulotis S, Rosenwaks Z, Ledger WJ, Witkin SS. Prevalence of cervical human papillomavirus in women undergoing in vitro fertilization and association with outcome. Fertil Steril 2006;86(3):765-7. doi: 10.1016/j.fertnstert.2006.01.051
- Henneberg AA, Patton WC, Jacobson JD, Chan PJ. Human papilloma virus DNA exposure and embryo survival is stage-specific. J Assist Reprod Genet 2006;23(6):255-259. doi: 10.1007/s10815-006-9030-8
- Foresta C, Patassini C, Bertoldo A, Menegazzo M, Francavilla F, Barzon L, et al. Mechanism of human papillomavirus binding to human spermatozoa and fertilizing ability of infected spermatozoa. PLoS One 2011;7,6(3):e15036. doi: 10.1371/journal.pone.0015036.
- Perino A, Giovannelli L, Schillaci R, Ruvolo G, Fiorentino FP, Alimondi P, et al. Human papillomavirus infection in couples undergoing in vitro fertilization procedures: impact on reproductive outcomes. Fertil Steril 2011;95(5):1845-1848. doi: 10.1016/j.fertnstert.2010.11.047
- Ferraretti AP, La Marca A, Fauser BC, Tarlatzis B, Nargund G, Gianaroli L; ESHRE working group on Poor Ovarian Response Definition. ESHRE consensus on the definition of 'poor response' to ovarian stimulation for in vitro fertilization: the Bologna criteria. Hum Reprod 2011;26(7):1616-24. doi: 10.1093/humrep/der092
- World Health Organization. WHO laboratory manual for the examination of human semen and sperm-cervical mucus interaction. 4th edition. Cambridge University Press, Cambridge, 1999. URL: https://www.cambridge.org/gb/academic/subjects/medicine/obstetrics-and-gynecology-reproductive-medicine/who-laboratory-manual-examination-human-semen-andsperm-cervical-mucus-interaction-4th-edition?format=PB&isbn=9780521645997
- Foresta C, Noventa M, De Toni L, Gizzo S, Garolla A. HPV-DNA sperm infection and infertility: from a systematic literature review to a possible clinical management proposal. Andrology 2015;3(2):163-173. doi: 10.1111/andr.284.
- Yang Y, Jia CW, Ma YM, Zhou LY, Wang SY. Correlation between HPV sperm infection and male infertility. Asian J Androl 2013;15(4):529-32. doi: 10.1038/aja.2013.36.
- Lee CA, Huang CT, King A, Chan PJ. Differential effects of human papillomavirus DNA types on p53 tumor-suppressor gene apoptosis in sperm. Gynecol Oncol 2002;85(3):511-6. doi: 10.1006/gyno.2002.6662.
- Schillaci R, Capra G, Bellavia C, Ruvolo G, Scazzone C, Venezia R, Perino A. Detection of oncogenic human papillomavirus genotypes on spermatozoa from male partners of infertile couples. Fertil Steril 2013;100(5):1236-40. doi: 10.1016/j.fertnstert.2013.06.042.
- Rintala MA, Grénman SE, Pöllänen PP, Suominen JJ, Syrjänen SM. Detection of highrisk HPV DNA in semen and its association with the quality of semen. Int J STD AIDS 2004;15(11):740-3. doi: 10.1258/0956462042395122.
- Garolla A, Lenzi A, Palù G, Pizzol D, Bertoldo A, De Toni L, Foresta C. Human papillomavirus sperm infection and assisted reproduction: a dangerous hazard with a possible safe solution. Hum Reprod 2012;27(4):967-73. doi: 10.1093/humrep/des009.
- Laprise C, Trottier H, Monnier P, Coutlée F, Mayrand MH. Prevalence of human papillomaviruses in semen: a systematic review and meta-analysis. Hum Reprod 2014;29(4):640-51. doi: 10.1093/humrep/det453.
- Foresta C, Pizzol D, Bertoldo A, Menegazzo M, Barzon L, Garolla A. Semen washing procedures do not eliminate human papilloma virus sperm infection in infertile patients. Fertil Steril 2011;96(5):1077-82. doi: 10.1016/j.fertnstert.2011.04.009.
- Gizzo S, Ferrari B, Noventa M, Ferrari E, Patrelli TS, Gangemi M, et al. Male and couple fertility impairment due to HPV-DNA sperm infection: update on molecular mechanism and clinical impact--systematic review. Biomed Res Int 2014;2014:230263. doi: 10.1155/2014/230263
- You H, Liu Y, Agrawal N, Prasad CK, Edwards JL, Osborne AF, et al. Multiple human papillomavirus types replicate in 3A trophoblasts. Placenta 2008;29(1):30-8. doi: 10.1016/j.placenta.2007.08.005.
- Gomez LM, Ma Y, Ho C, McGrath CM, Nelson DB, Parry S. Placental infection with human papillomavirus is associated with spontaneous preterm delivery. Hum Reprod 2008;23(3):709-15. doi: 10.1093/humrep/dem404.
- Hong LJ, Oshiro BT, Chan PJ. HPV-16 exposed mouse embryos: a potential model for pregnancy wastage. Arch Gynecol Obstet 2013;287(6):1093-7. doi: 10.1007/s00404-013-2711-5.
- Henneberg AA, Patton WC, Jacobson JD, Chan PJ. Human papilloma virus DNA exposure and embryo survival is stage-specific. J Assist Reprod Genet 2006;23(6):255-9. doi: 10.1007/s10815-006-9030-8.
- Conde-Ferráez L, Chan May Ade A, Carrillo-Martínez JR, Ayora-Talavera G, González-Losa Mdel R. Human papillomavirus infection and spontaneous abortion: a case-control study performed in Mexico. Eur J Obstet Gynecol Reprod Biol 2013;170(2):468-73. doi: 10.1016/j.ejogrb.2013.07.002.
- Matovina M, Husnjak K, Milutin N, Ciglar S, Grce M. Possible role of bacterial and viral infections in miscarriages. Fertil Steril 2004;81(3):662-9. doi: 10.1016/j.fertnstert.2003.08.020.
- Skoczyński M, Goździcka-Józefiak A, Kwaśniewska A. Prevalence of human papillomavirus in spontaneously aborted products of conception. Acta Obstet Gynecol Scand 2011;90(12):1402-5. doi: 10.1111/j.1600-0412.2011.01189.x.
- Noventa M, Andrisani A, Gizzo S, Nardelli GB, Ambrosini G. Is it time to shift the attention on early stages embryo development to avoid inconclusive evidence on HPVrelated infertility: debate and proposal. Reprod Biol Endocrinol 2014;12:48. doi: 10.1186/1477-7827-12-48.









Комментарии