Катибов М.И., Богданов А.Б.
Сведения об авторах:
- Катибов М.И. – д.м.н., доцент, заведующий урологическим отделением государственного бюджетного учреждения Республики Дагестан «Городская клиническая больница», профессор кафедры урологии ФГБОУ высшего образования «Дагестанский государствен- ный медицинский университет» Министерства здравоохранения Российской Федерации; Махачкала, Россия; РИНЦ AuthorID 633540
- Богданов А.Б. – к.м.н., врач-уролог урологического отделения ГБУЗ г. Москвы «Городская клиническая больница имени С.П. Боткина Департамента здравоохранения города Москвы», доцент кафедры урологии и хирургической андрологии ФГБОУ дополнительного профессионального образования «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации; Москва, Россия; РИНЦ AuthorID 742456
ВВЕДЕНИЕ
Врожденные аномалии мочеполовой системы относятся к числу наиболее частых видов пороков развития, составляя 20-30% всех врожденных дефектов [1, 2]. Среди них аномалии мочевого пузыря отличаются относительной редкостью, достаточно большим разнообразием возможных вариантов и частым сочетанием с другими врожденными аномалиями. В связи с этим достаточно сложно классифицировать все пороки развития мочевого пузыря. Тем не менее, выделяют следующие основные виды врожденных аномалий мочевого пузыря [3-5]:
- аномалии мочевого протока (урахуса);
- агенезия мочевого пузыря;
- гипоплазия мочевого пузыря;
- мегацистис;
- удвоение мочевого пузыря;
- дивертикул мочевого пузыря;
- экстрофия мочевого пузыря;
- контрактура шейки мочевого пузыря.
Аномалии мочевого пузыря в большинстве случаев могут быть идентифицированы с помощью пренатального ультразвукового исследования (УЗИ), но многие из них все еще диагностируются либо при рождении, либо на более поздних периодах развития ребенка в связи с различными клиническими проявлениями [6]. Пороки развития мочевого пузыря приводят к серьезным последствиям и обусловливают необходимость ранней адекватной лечебно-диагностической помощи таким пациентам. С учетом этого актуальным представляется обзор современных подходов к диагностике, лечению и профилактике потенциальных осложнений, связанных с данными аномалиями.
ОСНОВНАЯ ЧАСТЬ
I. Аномалии урахуса Урахус, соединяющий во время внутриутробного развития плода мочевой пузырь через пуповину с околоплодными водами, зарастает обычно к моменту рождения ребенка, однако в ряде случаев наблюдается его частичное или полное незаращение. Исходя из этого, выделяют следующие пороки развития урахуса (рис. 1) [7]:
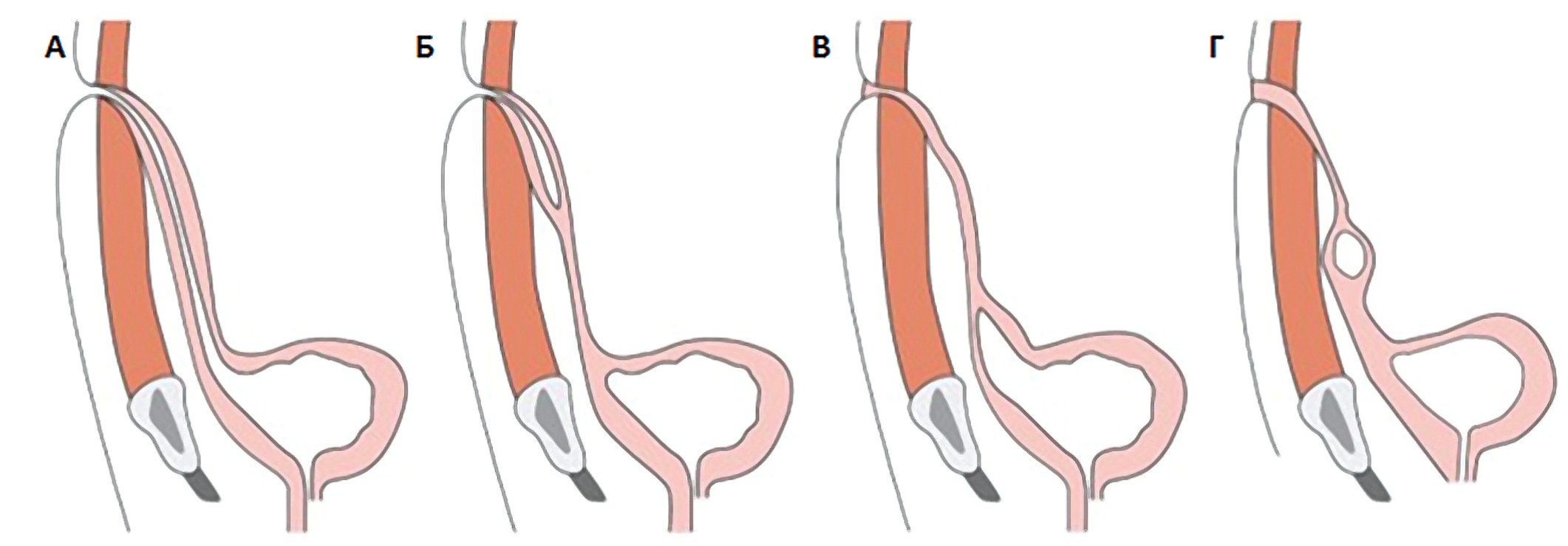
Рис. 1. Виды аномалий урахуса: А – пузырно-пупочный свищ; Б – урахусный синус; В – пузырно-урахусный дивертикул; Г – киста урахуса (схема) [12]
Fig. 1. Types of the urachal anomalies: A – urachal fistula; Б – urachal sinus; В – vesicourachal diverticulum; Г – urachal cyst (diagram) [12]
- Открытый урахус (пузырно-пупочный свищ) – полное незаращение урахуса, при котором отмечается постоянное выделение мочи из пупка на переднюю брюшную стенку;
- Урахусный синус (урахо-пупочный свищ) – частичное незаращение урахуса, при котором пузырная часть заращена, а пупочная часть остается открытой, и в результате этого наблюдаются постоянные выделения из пупка;
- Пузырно-урахусный дивертикул – частичное незаращение урахуса, при котором пузырная часть не заращена, а пупочная часть заращена;
- Киста урахуса – частичное незаращение урахуса, когда пузырная и пупочная конца заращены, и между ними в средней части остается незаращенным определенный сегмент.
В структуре данных пороков развития частота встречаемости имеет следующие значения: открытый урахус – 47-50%, урахусный синус – 15-18%, киста урахуса – 30%, пузырно-урахусный дивертикул – 3-5%. Аномалии урахуса чаще обнаруживают у взрослых (1:5000), а в детском возрасте намного реже – 1:150 000. При этом данная патология больше распространена среди лиц мужского пола [8-11].
Для диагностики аномалий урахуса применяются различные методы исследования: УЗИ, фистулография, цистография, компьютерная томография (КТ), магнитно-резонансная томография (МРТ) цистоскопия с введением в свищевой ход метиленового синего и обнаружением его в моче (рис. 2). Основной метод лечения – оперативный (открытое или лапароскопическое иссечение урахуса).
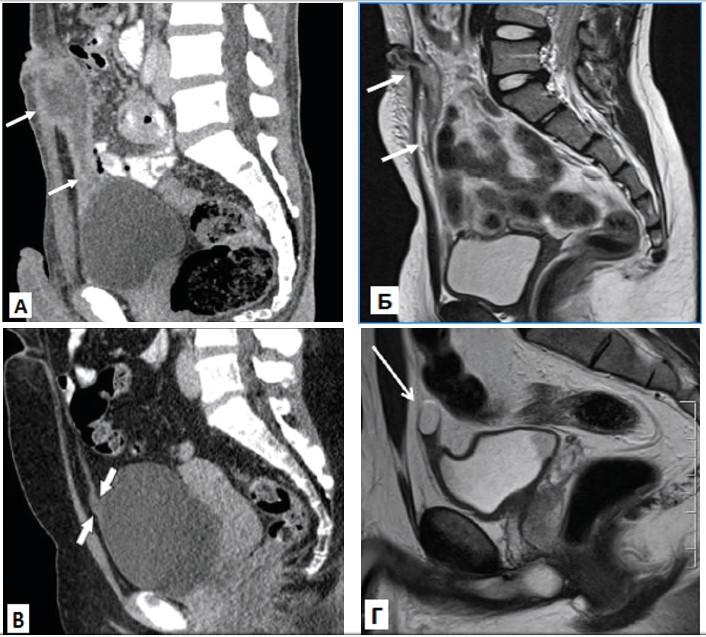
Рис. 2. Виды аномалий урахуса: А – пузырно-пупочный свищ (КТ); Б – урахусный синус (МРТ); В – пузырно-урахусный дивертикул (КТ); Г – киста урахуса (МРТ) [7]
Fig. 2. Types of the urachal anomalies: A – urachal fistula (CT); Б – urachal sinus (MRI); В – vesicourachal diverticulum (CT); Г – urachal cyst (MRI) [7]
II. Агенезия мочевого пузыря
Это врожденное отсутствие мочевого пузыря. Данная аномалия является крайне редкой и встречается приблизительно в 1 случае на 600 000 пациентов. Она обычно сочетается с пороками развития, несовместимыми с жизнью. Среди описанных в литературе 64 случаев с такой аномалией зарегистрировано только 25 живорожденных детей. При этом около 90% всех случаев были представлены женским полом. Порок совместим с жизнью при условии, если мочеточники эктопически впадают в нормально развитые мюллеровы структуры у девочек или в прямую кишку у мальчиков [13-15]. У выживших младенцев диагноз может быть подтвержден ретроградной уретеропиелографией с введением контраста через эктопические устья мочеточников, а также с помощью КТ и МРТ (рис. 3). Функция почек может быть сохранена путем создания уретеросигмоанастомоза или наружной уретеростомы (уретерокутанеостомы).
III. Гипоплазия мочевого пузыря
Данная аномалия представляет собой мочевой пузырь с малой емкостью и недоразвитой стенкой. Она развивается вследствие недостаточного наполнения или накопления мочи во время внутриутробного развития, из-за чего мочевой пузырь не достигает адекватной емкости. Это может быть вызвано тремя группами факторов:
- неадекватное сопротивление выходного отверстия мочевого пузыря (тяжелая эписпадия, аномалии урогенитального синуса);
- пороки развития паренхимы почек, вызывающие очень низкий диурез (двусторонняя дисплазия почек, агенезия почки);
- эвакуация мочи из верхних мочевых путей в обход мочевого пузыря (эктопия мочеточника) [6, 16].
Диагностика основана на данных лучевых (УЗИ, КТ, МРТ, цистография) и эндоскопических (цистоскопия) методов исследования (рис. 4). В некоторых случаях мочевой пузырь увеличивается после коррекции пороков развития и восстановления циклического поступления мочи в мочевой пузырь, однако для достижения адекватной емкости чаще требуется аугментация мочевого пузыря (увеличение стенки мочевого пузыря за счет замещения другой тканью).
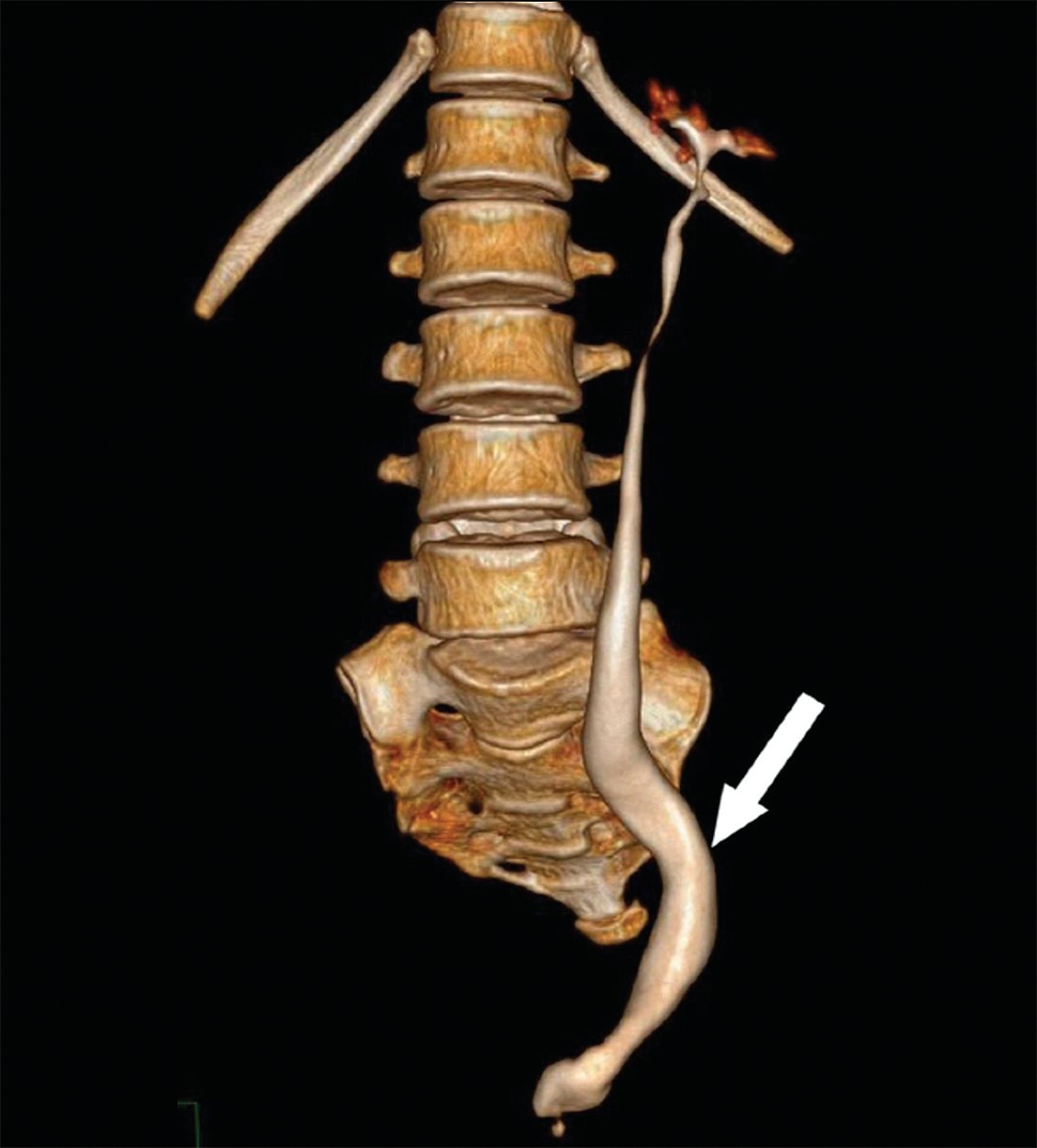
Рис. 3. Агенезия мочевого пузыря с агенезией правой почки (стрелка указывает на расширенный левый мочеточник в средней и нижней трети по данным КТ) [13]
Fig. 3. Agenesis of the urinary bladder with agenesis of the right kidney (the arrow points to the dilated left ureter in the middle and lower third according to CT) [13
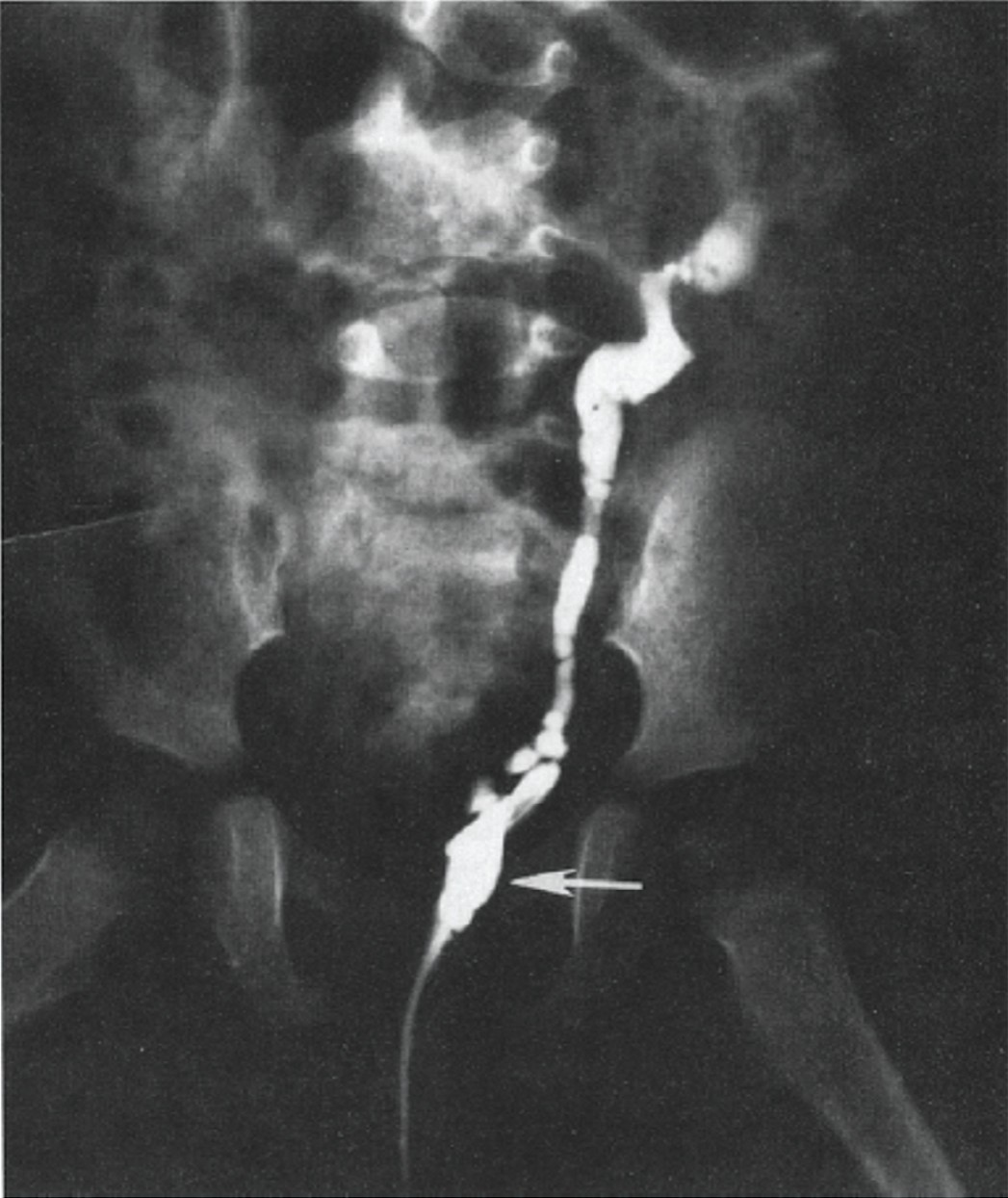
Рис. 4. Гипоплазия мочевого пузыря (стрелка) с рефлюксом в единственный левый мочеточник (ретроградная цистография) [16]
Fig. 4. Bladder hypoplasia (arrow) with reflux in the single left ureter (retrograde cystography) [16]
IV. Мегацистис
Данный порок развития проявляется в виде расширенного тонкостенного мочевого пузыря с широким и недостаточно развитым треугольником Льето без инфравезикальной обструкции. Устья мочеточников расширены в 2 раза и смещены в сторону, что обусловливает массивный пузырно-мочеточниковый рефлюкс (рис. 5). Сократимость мочевого пузыря находится в норме, хотя большая часть мочи забрасывается в мочеточники при каждом мочеиспускании. Никаких сопутствующих нейрогенных аномалий не отмечается [17, 18].
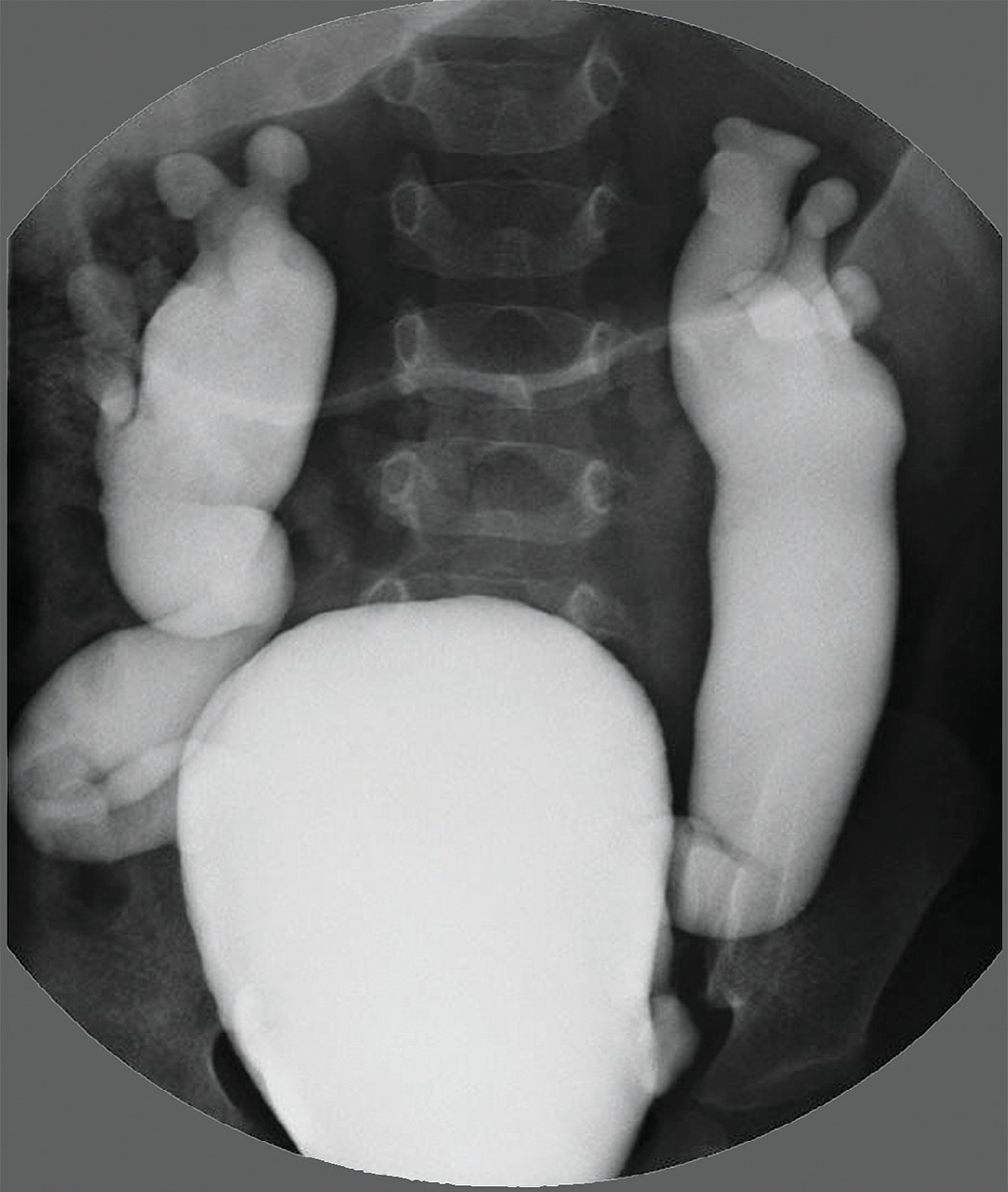
Рис. 5. Мегацистис с двусторонним пузырно-мочеточниковым рефлюксом (микционная цистография) [19]
Fig. 5. Megacystis with bilateral vesicoureteral reflux (voiding cystography) [19]
В большинстве случаев данный порок диагностируют пренатально по данным УЗИ (рис. 6). После рождения таким пациентам следует назначать профилактические курсы антибактериальной терапии. Коррекция пузырно-мочеточникового рефлюкса путем реимплантации мочеточников часто позволяет восстановить нормальную динамику мочеиспускания и должна проводиться в первые 6-9 месяцев жизни. При расширении мочеточников в дистальном отделе более чем на 1 см для их успешной реимплантации может потребоваться проведение их сужения. Кроме этого, возможным вариантом оперативного лечения является редукционная цистопластика (операция по уменьшению объем мочевого пузыря), но обычно ее применяют редко. Такая операция затруднена из-за тонкости стенки мочевого пузыря, несмотря на то что даже у грудных детей мочевой пузырь имеет достаточно большие размеры, позволяющие вместить сужающие мочеточники.
Врожденный мегацистис встречается еще в сочетании с микроколоном и гипоперистальтикой желудочно-кишечного тракта, что называется синдромом Бердона и является крайне редкой аномалией. Данный синдром, в основном, встречается у лиц женского пола и обычно ассоциирован с очень высокой летальностью. Пациенты редко доживают до первого года жизни и нуждаются в постоянном парентеральном питании. Расширенный мочевой пузырь требует дренирования с помощью периодической катетеризации или установки цистостомы [21, 22].
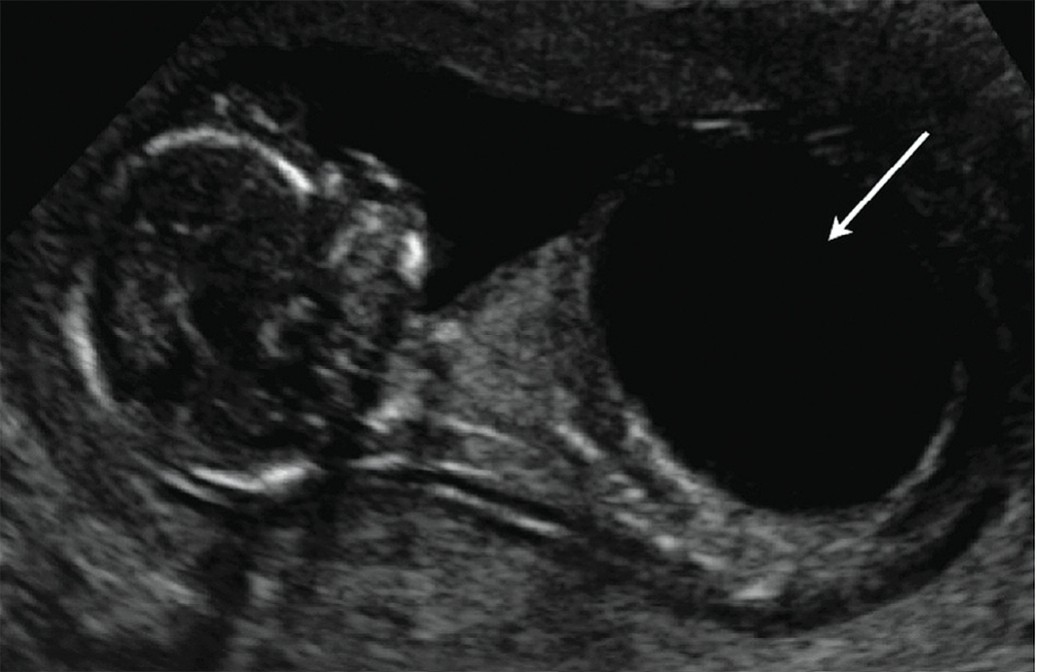
Рис. 6. Мегацистис у плода в первом триместре (УЗИ) [20]
Fig. 6. Megacystis of the fetus in the first trimester (ultrasound) [20]
V. Удвоение мочевого пузыря
Данная аномалия является очень редкой, и в литературе описано всего около 70 таких случаев. Удвоение мочевого пузыря может быть полным и неполным. Оно может произойти как в сагиттальной, так и во фронтальной плоскости. Из всех вариантов удвоения мочевого пузыря наиболее частым является полное дублирование в сагиттальной плоскости с удвоением уретры. В литературе описано всего около 50 случаев полного удвоения мочевого пузыря [23].
При полном удвоении имеет место наличие двух мочевых пузырей, полностью разделенных брюшной складкой. Хотя размер и качество каждого пузыря могут быть разными, они обычно снабжены собственным мочеточником и дренируются через индивидуальную уретру. В редких случаях в одном мочевом пузыре может отсутствовать уретра. Это приводит к ипсилатеральной почечной дисплазии в результате полной обструкции. Оба мочевого пузыря могут обладать достаточным механизмом удержания мочи, но иногда данная функция может быть нарушена с одной стороны, что вызывает эпизоды недержания мочи [24].
При неполном удвоении имеет место наличие общей шейки мочевого пузыря и уретры для обоих пузырей. В ряде случаев при неполном удвоении перегородка между половинами мочевого пузыря может быть неполной, что приводит к сообщению их между собой – «двухкамерный» мочевой пузырь. Анатомическая структура при неполном удвоении сильно варьирует: в некоторых случаях имеется дуплексная шейка мочевого пузыря, но соединенный общий дистальный отдел уретры, а в других случаях – единственная шейка мочевого пузыря при удвоении камер мочевого пузыря [22, 23].
Удвоенный пузырь часто сочетается с удвоением наружных половых органов (до 90% случаев) и нижних отделов желудочно-кишечного тракта (до 50% случаев), с различными другими урологическими аномалиями (пузырно-мочеточниковый рефлюкс, дистопия или дисплазия почки), свищами между урогенитальным и желудочно-кишечным трактами [24-27].
Из-за широкого спектра анатомических проявлений удвоения мочевых пузырей клиническое проявление и диагностика заболевания могут иметь различные временные сроки. При сопутствующих пороках развития желудочно-кишечного тракта или наружных половых путей диагноз часто устанавливают в период новорожденности. Однако у многих детей диагноз остается неизвестным до манифестации инфекции мочеполовых органов или эпизодов недержания мочи. Для диагностики указанной аномалии могут быть применены кариотипирование, УЗИ, экскреторная урография с нисходящей цистографией, ретроградная и микционная цистоуретрография, КТ, МРТ, видеоуродинамические и эндоскопические исследования (рис. 7).
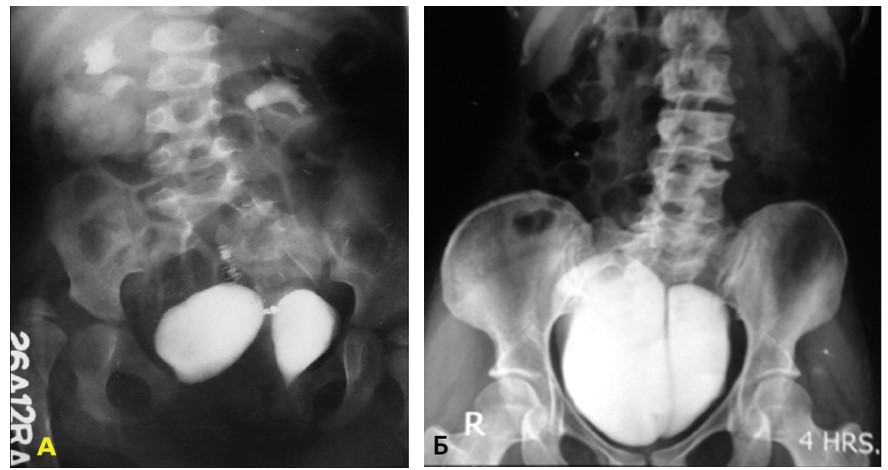
Рис. 7. Экскреторная урография: А – полное удвоение мочевого пузыря; Б – неполное удвоение мочевого пузыря [27]
Fig. 7. Excretory urography: A – complete bladder duplication; B – incomplete bladder duplication [27]
Выбор лечения зависит от клинических признаков, а оперативное лечение должно быть строго индивидуализировано в зависимости от анатомического строения. Неполное удвоение может не потребовать хирургического лечения при удовлетворительном дренировании обеих половин мочевого пузыря через общую уретру, либо в зависимости от ситуации может быть удалена перегородка между двумя камерами и создан единственный мочевой пузырь. При полном удвоении оба пузыря могут быть объединены в один, если оба сфинктера полноценно удерживают мочу, а дистальные отделы уретры соединены между собой. Если один из сфинктеров неполноценно удерживает мочу, то шейка мочевого пузыря с соответствующей стороны может быть закрыта, а соединенная уретра иссечена. Во всех случаях первоочередными задачами лечения должны быть устранение обструкции любой формы и сохранение оптимальной функции почек, а достижение удержания мочи и косметическая реконструкция гениталий производятся во вторую очередь [6].
VI. Дивертикул мочевого пузыря
Представляет собой образование мешковидного выпячивания стенки мочевого пузыря наружу и чаще всего располагается на заднебоковой стенке мочевого пузыря, выше и латеральнее устья мочеточника. Врожденный (истинный) дивертикул содержит в своей стенке все слои мочевого пузыря, что отличает его от приобретенного (ложного) дивертикула, возникающего при инфравезикальной обструкции.
Частота встречаемости дивертикулов мочевого пузыря в популяции детей составляет 1,7% [28]. Наиболее частым вариантом дивертикула мочевого пузыря является парауретеральный дивертикул (дивертикул Хатча), который возникает в результате неполной мышечной поддержки вокруг места входа мочеточника в мочевой пузырь, что приводит к выпячиванию наружу слизистой оболочки мочевого пузыря вокруг устья мочеточника. Существуют еще первичные дивертикулы мочевого пузыря, которые могут развиваться в других местах мочевого пузыря и часто являются вторичными по отношению к врожденным заболеваниям соединительной ткани (синдромы Элерса-Данлоса, Вильямса или Менкеса) [28-31].
Большинство дивертикулов мочевого пузыря небольшие, бессимптомные и не требуют вмешательства. При больших размерах они плохо опорожняются и могут проявляться в виде двухэтапного мочеиспускания, когда вначале опорожняется мочевой пузырь, а после незначительной паузы – дивертикул. Постоянный застой мочи в дивертикуле способствует камнеобразованию и развитию хронического воспалительного процесса.
Диагноз устанавливается на основании УЗИ, цистографии, КТ, МРТ и цистоскопии (рис. 8).
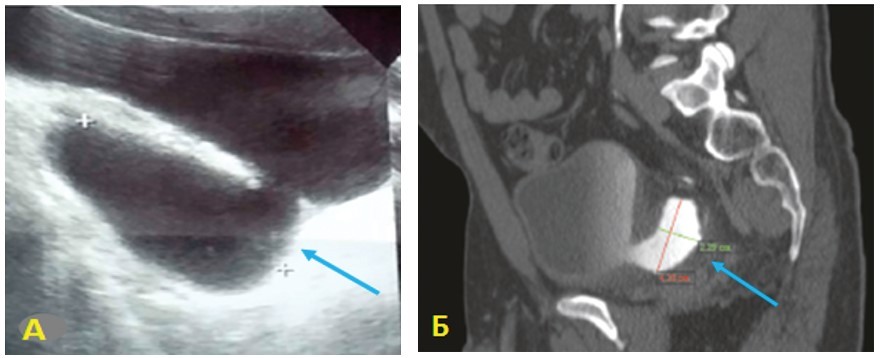
Рис. 8. Врожденный дивертикул мочевого пузыря: А – УЗИ; Б – КТ [32]
Fig. 8. Congenital bladder diverticulum: A - ultrasound; Б – CT [32]
Показаниями к дивертикулэктомии мочевого пузыря служат неподдающиеся консервативному лечению симптомы нарушения функции нижних мочевых путей, хронические рецидивирующие инфекции мочевыводящих путей, камни в дивертикуле, ухудшение состояния верхних мочевыводящих путей в результате обструкции или рефлюкса, карцинома или предраковые изменения [32-35].
VII. Экстрофия мочевого пузыря
Аномалия представляет собой отсутствие передней стенки мочевого пузыря и соответствующей части передней брюшной стенки. В образовавшемся дефекте определяется задняя стенка мочевого пузыря и устья мочеточников. Экстрофии мочевого пузыря сопутствуют отсутствие передней стенки уретры и симфиза, а также диастаз костей лонного сочленения, в результате чего наблюдается «утиная» походка ребенка. Выделяющаяся постоянно наружу моча омывает кожу промежности, половых органов и бедер, вызывая их мацерацию и изъязвление. При натуживании (смех, крик, плач, кашель) стенка мочевого пузыря выпячивается в виде шара, а выделение мочи усиливается. Слизистая оболочка мочевого пузыря гиперемирована, легко кровоточит. Постоянное соприкосновение слизистой оболочки мочевого пузыря и уретры с внешней средой способствует развитию хронического цистита и пиелонефрита [36-38].
Данная аномалия встречается у новорожденных с частотой 1:10 000-50 000, у мальчиков – в 2-6 раз чаще [6, 39, 40]. Риск возникновения экстрофии мочевого пузыря у последующих братьев и сестер составляет примерно 1%, а такой риск у детей, рожденных от родителей с указанным пороком, примерно в 500 раз выше относительно популяции в целом. Часто при экстрофии мочевого пузыря наблюдаются аномалии развития верхних и нижних мочевых путей, матки, влагалища, эписпадия, паховая грыжа, крипторхизм, выпадение прямой кишки и другие пороки [39-41].
Диагностика экстрофии мочевого пузыря несложна – наличие порока устанавливают сразу после рождения при осмотре ребенка (рис. 9).
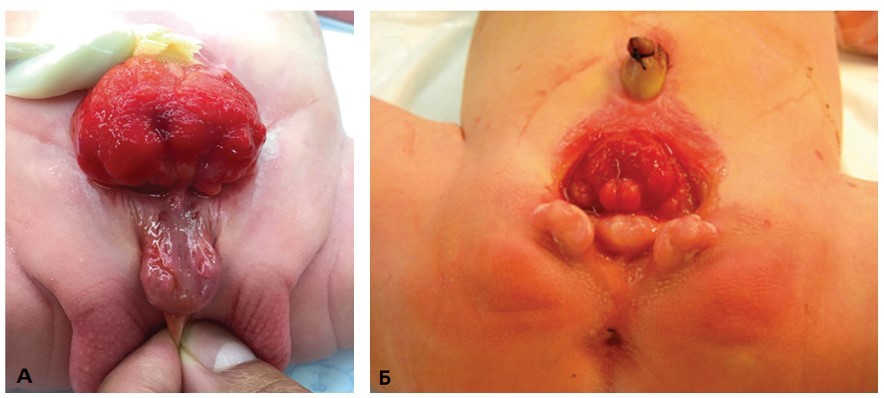
Рис. 9. Экстрофия мочевого пузыря: А – у мальчика; Б – у девочки [5]
Fig. 9. Bladder exstrophy: A – boy; Б – girl [5]
Возможна и внутриутробная диагностика данного порока развития. Характерным его ультразвуковым признаком служит отсутствие тени мочевого пузыря при серии последовательных обследований, т.е. отсутствие наполнения мочевого пузыря в период внутриутробного развития плода [42].
Лечение только оперативное, которое целесообразно провести в первые месяцы жизни ребенка, даже в первые 48 ч после рождения. Суть оперативного лечения заключается в сближении костей лонного сочленения, формировании передней стенки мочевого пузыря за счет местных тканей, сфинктера мочевого пузыря и пластике передней брюшной стенки. Такие методы, как аллопластика стенки мочевого пузыря и кишечная деривация мочи, в настоящее время проводятся редко. Коррекцию эписпадии, которая присутствует при экстрофии мочевого пузыря, проводят в более поздние сроки – после двух лет жизни. В большинстве наблюдений после первого этапа оперативного лечения не удается добиться полного удержания мочи, поэтому только после ряда последующих операций удается обеспечить полное удержание мочи [43-47].
VIII. Контрактура шейки мочевого пузыря (болезнь Мариона)
Редкая аномалия, которая представляет собой избыточное развитие соединительной ткани в подслизистом и мышечном слоях шейки мочевого пузыря. Проявление заболевания существенно зависит от выраженности фиброзных изменений в области шейки мочевого пузыря и связанных с ними обструктивных нарушений. Симптомы могут варьировать от незначительного затруднения мочеиспускания до развития острой или хронической задержки мочи. В качестве возможных осложнений данного порока развития могут быть выделены хронический пиелонефрит, формируются пузырно-мочеточниковый рефлюкс, уретерогидронефроз и хроническая почечная недостаточность. Для диагностики используются такие методы, как уретроцистография, урофлоуметрия в сочетании с цистоманометрией, уретроцистоскопия с биопсией шейки мочевого пузыря (рис. 10). При незначительной степени выраженности заболевания может быть использовано периодическое бужирование уретры, а при более тяжелых случаях рекомендуется трансуретральное рассечение или иссечение рубцовых тканей, а также открытая V-образная пластика шейки мочевого пузыря [36, 48].
ЗАКЛЮЧЕНИЕ
В данной статье в лекционной форме достаточно подробно освещены сведения, касающиеся основных вопросов терминологии, классификации и эпидемиологии наиболее часто встречающихся врожденных аномалий мочевого пузыря. Изложены принципы современных подходов к диагностике и лечению при этих пороках развития. При этом все рассматриваемые варианты аномалий были проиллюстрированы данными лучевых методов диагностики либо изображениями внешнего вида таких наблюдений.
Представленный материал может быть рекомендован для использования в практической деятельности врачей-специалистов разного профиля, в образовательном процессе медицинских вузов при подготовке студентов различных специальностей, кадров высшей квалификации по программам ординатуры и научнопедагогических кадров в аспирантуре, при последипломном обучении врачей по программам повышения квалификации и профессиональной переподготовки по специальности «Урология», а также в научно-исследовательских учреждениях при проведении научных исследований.
ЛИТЕРАТУРА
- dos Santos Junior AC, de Miranda DM, Simões e Silva AC. Congenital anomalies of the kidney and urinary tract: an embryogenetic review. Birth Defects Res C Embryo Today 2014;102(4):374-81. https://doi.org/10.1002/bdrc.21084.
- Васильев А.О., Говоров А.В., Пушкарь Д.Ю. Эмбриональные аспекты врожденных аномалий почек и мочевых путей (CAKUT-синдром). Вестник урологии 2015;(2):47-60. [Vasilyev A.O., Govorov A.V., Pushkar D.Y. Embryological aspects of сongenital anomalies of the kidney and urinary tract (CAKUT): Review. Vestnik urologii = Urology Herald 2015;(2):47-60. (In Russian)].
- Berrocal T, López-Pereira P, Arjonilla A, Gutiérrez J. Anomalies of the distal ureter, bladder, and urethra in children: embryologic, radiologic, and pathologic features. Radiographics 2002;22(5):1139-64. https://doi.org/10.1148/radiographics.22.5.g02se101139.
- Janjua HS, Lam SK, Gupta V, Krishna S. Congenital Anomalies of the kidneys, collecting system, bladder, and urethra. Pediatr Rev 2019;40(12):619-626. https://doi.org/10.1542/pir.2018-0242.
- Al-Salem AH. An Illustrated Guide to Pediatric Urology. Springer, Switzerland, 2017; 337-379 p. https://doi.org/10.1007/978-3-319-44182-5.
- Barakat AJ, Gil Rushton H, eds. Congenital Anomalies of the Kidney and Urinary Tract. Clinical Implications in Children. Springer, Switzerland, 2016;175-197 p. https://doi.org/10.1007/978-3-319-29219-9.
- Parada Villavicencio C, Adam SZ, Nikolaidis P, Yaghmai V, Miller FH. Imaging of the urachus: anomalies, complications, and mimics. Radiographics 2016;36(7):2049-2063. https://doi.org/10.1148/rg.2016160062.
- Choi YJ, Kim JM, Ahn SY, Oh JT, Han SW, Lee JS. Urachal anomalies in children: a single center experience. Yonsei Med J 2006;47(6):782-6. https://doi.org/10.3349/ymj.2006.47.6.782.
- Nimmonrat A, Na-ChiangMai W, Muttarak M. Urachal abnormalities: clinical and imaging features. Singapore Med J 2008;49(11):930-935.
- Buddha S, Menias CO, Katabathina VS. Imaging of urachal anomalies. Abdom Radiol (NY) 2019;44(12):3978-3989. https://doi.org/10.1007/s00261-019-02205-x.
- Поддубный И.В., Исаев Я.А. Аномалии мочевого протока у детей. Российский вестник детской хирургии, анестезиологии и реаниматологии 2015;5(2):83-92. [Poddubny I.V., Isaev Ya.A. Urachal anomalies in children: diagnostics and treatment. Literature review. Rossijskij vestnik detskoj hirurgii, anesteziologii i reanimatologii = Russian Journal of Pediatric Surgery, Anesthesia and Intensive Care 2015;5(2):83-92. (In Russian)].
- Tazi F, Ahsaini M, Khalouk A, Mellas S, Stuurman-Wieringa RE, Elfassi MJ, Farih MH. Abscess of urachal remnants presenting with acute abdomen: a case series. J Med Case Rep 2012(6):226. https://doi.org/10.1186/1752-1947-6-226.
- Indiran V, Chokkappan K, Gunaseelan E. Rare case of urinary bladder agenesis--multislice CT abdomen imaging. J Radiol Case Rep 2013;7(2):44-49. https://doi.org/10.3941/jrcr.v7i2.1326.
- Nazer II, Alhashmi G, Sharief SN, Hefni NA, Ibrahim A, El-Desoky SM, et al. A case of urinary bladder agenesis and bilateral ectopic ureters: a case report. BMC Urol 2018;18(1):83. https://doi.org/10.1186/s12894-018-0396-6.
- Nazim SM, Zaidi Z. Bilateral ectopic ureters with bladder agenesis. J Pak Med Assoc 2012;62(10):1086-9.
- Meriwether JH, Witherington R. Hypoplasia of urinary bladder. Urology 1992;39(4):327-30. https://doi.org/10.1016/0090-4295(92)90207-d.
- Taghavi K, Sharpe C, Stringer MD. Fetal megacystis: A systematic review. J Pediatr Urol 2017;13(1):7-15. https://doi.org/10.1016/j.jpurol.2016.09.003.
- Osborne NG, Bonilla-Musoles F, Machado LE, Raga F, Bonilla F Jr, Ruiz F, et al. Fetal megacystis: differential diagnosis. J Ultrasound Med 2011;30(6):833-41. https://doi.org/10.7863/ jum.2011.30.6.833.
- Hodges SJ, Werle D, McLorie G, Atala A. Megaureter. ScientificWorldJournal 2010(10):603-12. https://doi.org/10.1100/tsw.2010.54.
- Hindryckx A, De Catte L. Prenatal diagnosis of congenital renal and urinary tract malformations. Facts Views Vis Obgyn 2011;3(3):165-74.
- Mc Laughlin D, Puri P. Familial megacystis microcolon intestinal hypoperistalsis syndrome: a systematic review. Pediatr Surg Int 2013;29(9):947-51. https://doi.org/10.1007/s00383-013-3357-x.
- Wymer KM, Anderson BB, Wilkens AA, Gundeti MS. Megacystis microcolon intestinal hypoperistalsis syndrome: Case series and updated review of the literature with an emphasis on urologic management. J Pediatr Surg 2016;51(9):1565-73. https://doi.org/10.1016/ j.jpedsurg.2016.06.011.
- Gajbhiye V, Nath S, Ghosh P, Chatterjee A, Haldar D, Das SK. Complete duplication of the urinary bladder: An extremely rare congenital anomaly. Urol Ann 2015;7(1):91-93. https://doi.org/10.4103/0974-7796.148629.
- Coker AM, Allshouse MJ, Koyle MA. Complete duplication of bladder and urethra in a sagittal plane in a male infant: case report and literature review. J Pediatr Urol 2008;4(4):255-9. https://doi.org/10.1016/j.jpurol.2008.02.001.
- Evangelidis A, Murphy JP, Gatti JM. Incomplete bladder duplication presenting antenatally. Urology 2004;64(3):589. https://doi.org/10.1016/j.urology.2003.12.011.
- Voigt HR, Wentzel SW. Complete duplication of the bladder, urethra and external genitalia in a male neonate with an imperforate anus. Int J Urol 2005;12(7):702-4. https://doi.org/10.1111/ j.1442-2042.2005.01131.x.
- Awasthi NK, Goel H, Mahapatra R, Pal D. Incomplete bladder duplication with multiple congenital anomalies: A rare presentation. Urol Ann 2015;7(1):88-90. https://doi.org/10.4103/0974-7796.148628.
- Pirinççi N, Geçit I, Güneş M, Tanık S, Ceylan K. Complete duplication of the bladder and urethra in the coronal plane: case report with review of the literature. Urol Int 2013;90(1):118-20. https://doi.org/10.1159/000339922.
- Abou Zahr R, Chalhoub K, Ollaik F, Nohra J. Сongenital bladder diverticulum in adults: a case report and review of the literature. Case Rep Urol 2018;9748926. https://doi.org/10.1155/2018/9748926.
- Garat JM, Angerri O, Caffaratti J, Moscatiello P, Villavicencio H. Primary congenital bladder diverticula in children. Urology 2007;70(5):984-8. https://doi.org/10.1016/j.urology.2007.06.1108.
- Hebert KL, Martin AD. Management of bladder diverticula in menkes syndrome: a case report and review of the literature. Urology 2015;86(1):162-4. https://doi.org/0.1016/j.urology.2015.03.030.
- Nerli RB, Ghagane SC, Musale A, Deole S, Hiremath MB, Dixit NS, Pathan P. Congenital bladder diverticulum in a child: Surgical steps of extra-vesical excision. Urol Case Rep 2018(22):42-43. https://doi.org/10.1016/j.eucr.2018.10.009.
- Khemakhem R, Ghorbel S, Jlidi S, Nouira F, Louati H, Douira W, et al. Management of congenital bladder diverticulum in children: A report of seven cases. Afr J Paediatr Surg 2013;10(2):160-3. https://doi.org/10.4103/0189-6725.115044.
- Celebi S, Sander S, Kuzdan O, Özaydın S, Beşik Beştaş C, Yavuz S, et al. Current diagnosis and management of primary isolated bladder diverticula in children. J Pediatr Urol 2015;11(2):61. e1-5. https://doi.org/10.1016/j.jpurol.2014.10.004.
- Alexander RE, Kum JB, Idrees M. Bladder diverticulum: clinicopathologic spectrum in pediatric patients. Pediatr Dev Pathol 2012;15(4):281-5. https://doi.org/10.2350/12-02-1154-OA.1.
- Разин М.П., Галкин В.Н., Сухих Н.К. Детская урология-андрология: Учебное пособие. М.: ГЭОТАР-Медиа, 2011;128 с. [Razin M.P., Galkin V.N., Suhih N.K. Detskaya urologiya-andrologiya: Uchebnoe posobie. Moscow: GEOTAR-Media, 2016; 128 p. (In Russian)].
- Рудин Ю.Э., Марухненко Д.В., Алиев Д.К. Предоперационная оценка тяжести порока развития полового члена у мальчиков с эписпадией и экстрофией мочевого пузыря. Экспериментальная и клиническая урология 2017;(4):102-105. [Rudin Yu.E., Marukhnenko D.V., Aliev D.K. Preoperative evaluation ofseverity of malformation of enisin boys with epispadias and bladder exstrophy. Eksperimental'naya i klinicheskaya urologiya = Experimental and Сlinical urology 2017;(4):102-105. (In Russian)].
- Antomarchi J, Moeglin D, Laurichesse H, Combourieu D, Bigi N, Maisonneuve E, et al. The Pubic Diastasis Measurement, a Key Element for the Diagnosis, Management, and Prognosis of the Bladder Exstrophy. Fetal Diagn Ther 2019;45(6):435-440. https://doi.org/10.1159/000492817.
- Ахунзянов А.А., Рашитов Л.Ф. Экстрофия мочевого пузыря. Казанский медицинский журнал 2002 83(2):131-134. [Akhunzyanov A.A., Rashitov L.F. Bladder exstrophy. Kazanskij medicinskij zhurnal = Kazan medical journal 2002 83(2):131-134. (In Russian)].
- Аверин В.И., Кандратьева О.В., Забаровский А.В., Сташков А.К. Экстрофия мочевого пузыря: современное состояние проблемы (обзор литературы). Хирургия детского возраста 2018(3):100-104. https://doi.org/10.15574/PS.2018.60.100. [Averin V.I., Kandratyeva O.V., Zabarovsky A.V., Stashkov A.K. Exstrophy of the bladder: status update on the problem (a literature review). Hirurgija detskogo vozrasta = Paediatric surgery 2018(3):100-104. https://doi.org/10.15574/ PS.2018.60.100. (In Russian)].
- Jayachandran D, Bythell M, Platt MW, Rankin J. Register based study of bladder exstrophyepispadias complex: prevalence, associated anomalies, prenatal diagnosis and survival. J Urol 2011;186(5):2056-60. https://doi.org/10.1016/j.juro.2011.07.022.
- Mallmann MR, Mack-Detlefsen B, Reutter H, Pohle R, Gottschalk I, Geipel A, et al. Isolated bladder exstrophy in prenatal diagnosis. Arch Gynecol Obstet 2019;300(2):355-363. https://doi.org/10.1007/s00404-019-05193-x.
- Рудин Ю.Э., Марухненко Д.В., Чекериди Ю.Э. Первичная пластика мочевого пузыря местными тканями при экстрофии у детей. Экспериментальная и клиническая урология 2010(1):69-75. [Rudin Yu.E., Maruhnenko D.V., Chekeridi Yu.E. Primery bladder reconstruction with local flaps in children with extrofy. Eksperimental'naya i klinicheskaya urologiya = Experimental and clinical urology 2010(1):69-75. (In Russian)].
- Осипов И.Б., Красильников Д.Е., Соснин Е.В. Хирургические методы отведения мочи при лечении комплекса экстрофии-эписпадии у детей. Андрология и генитальная хирургия 2011;12(2):35-40. [Osipov I.B., Krasilnikov D.E., Sosnin E.V. Surgical methods of urinary diversion in treatment of exstrophy–epispadias complex in children. Andrologiya i genital'naya khirurgiya = Andrology and Genital Surgery 2011;12(2):35-40. (In Russian)].
- Pathak P, Ring JD, Delfino KR, Dynda DI, Mathews RI. Complete primary repair of bladder exstrophy: a systematic review. J Pediatr Urol 2020;16(2):149-153. https://doi.org/10.1016/j.jpurol.2020.01.004.
- Pierre K, Borer J, Phelps A, Chow JS. Bladder exstrophy: current management and postoperative imaging. Pediatr Radiol 2014;44(7):768-86. https://doi.org/10.1007/s00247-014-2892-5.
- Dunn EA, Kasprenski M, Facciola J, Benz K, Maruf M, Zaman MH, et al. Anatomy of Classic Bladder Exstrophy: MRI Findings and Surgical Correlation. Curr Urol Rep 2019;20(9):48. https://doi.org/10.1007/s11934-019-0916-2.
- Padmanabhan P, Nitti VW. Primary bladder neck obstruction in men, women, and children. Curr Urol Rep 2007;8(5):379-84. https://doi.org/10.1007/s11934-007-0035-3.
- King LR. Contracture of the Bladder Neck. Surg Clin North Am 1964;44(6):1537-1550









Комментарии