Карнаух П.А., Яйцев С.В., Важенин А.В., Золотых М.А., Перетрухин А.А.
ГБУЗ «Челябинский окружной клинический онкологический диспансер», ЮУНЦ РАМН Южноуральский Государственный Медицинский Университет 454000, Челябинск, улица Блюхера 42
Эл.почта: oncourolchel1@rambler.ru, jaitsev@yandex.ru, roc_chel@mail.ru, urogb1@mail.ru, sosiska-84@mail.ru
Цель исследования: разработать алгоритм послеоперационного наблюдения за пациентами после перенесенного хирургического лечения, коррекции возникающей у части из них эректильной дисфункции.
Введение. Рак простаты является большой социальной и медицинской проблемой.
В России число впервые выявленных случаев возрастает с каждым годом. В США пик заболеваемости пришѐлся на 1991 год, и затем понижался ежегодно на 4,5% ежегодно с 1994 по 1998 годы.
В 2012 году было выявлено 217000 новых случаев рака простаты. А у более чем у 32000 пациентов он явился причиной смерти. По частоте выявления у мужчин рак простаты находится на 1 месте. Среди причин смерти на втором месте, после рака лѐгкого.
Текущее увеличение числа пациентов с диагностированным раком простаты больше, чем с любыми другими солидными опухолями. Такая высокая заболеваемость зависит от многих факторов, включающих значительную осведомлѐнность врача и пациента, внедрение исследования простатспецифического антигена в клиническую практику и относительную лѐгкость и доступность трансректальной мультифокальной биопсии простаты под ультразвуковым наведением.
Всѐ вышеуказанное привело к тому, что появилось большое количество случаев рака простаты которые можно излечить.
С повышением частоты рака простаты и определением эффективности хирургического лечения существенно увеличилось количество радикальных простатэктомий.
В Швеции, где популярно отсроченное лечение рака простаты, были проведены очень интересные исследования. Аус с сотрудниками в 1994 году провѐл ретроспективное исследование: проанализировал 514 пациентов, умерших от рака простаты.
Была проанализирована история болезни 514 больных раком простаты, умерших от рака простаты в период с 1988 по 1991 годы. Максимальный срок от установления диагноза до смерти составил 25 лет. Автор пришел к поразительным выводам:
Во-первых, срок наблюдения при оценке выживаемость больных раком простаты является чрезвычайно важным показателем. Так из всех больных не имевших метастазов на момент установления диагноза, 50% в конечном итоге погибли от прогрессирования заболевания. Смертность же больных проживших более 10 лет составила 63%. Таким образом, смертность от рака простаты не снижается после 10 лет наблюдения, а наоборот, оказывается удивительно высокой при увеличении более 10 лет.
Минимальным периодом наблюдения для правильной оценке раковоспецифичной выживаемости является срок в 15 лет. Причѐм Хаггсон с коллегами отмечает, что это является справедливым в отношении всех стадий и степеней дифференцировки Аус отмечает важность возраста на момент установления диагноза. Среди больных моложе 65 лет 75: в конечном итоге умирают от рака простаты при отсутствии радикального лечения.
Другое не менее интригующее ретроспективное исследование, проведѐнное также в Швеции Гронберг в 1994 году, и включающее 6890 пациентов, аналогично продемонстрировало роль возраста пациентов. Так у больных с высокодифференцированной аденокарциномой простаты сокращение жизни колеблется в зависимости от возраста на момент установления диагноза – от 1,2 года у мужчин старше 75 лет, до 11 лет у мужчин в возрасте 45-50 лет. Смертность больных моложе 60 лет составила 80%, от 60-69 лет 63%, 53% у мужчин 70-79 лет и 49% у мужчин старше 80 лет.
Вышеприведенную информацию необходимо рассматривать в контексте других исследований согласно которым, тот же Гронберг в 1997 году, в Швеции 55% пациентов умирает непосредственно от рака простаты, а в США, где широко распространены радикальные методы лечения: простатэктомии и различные модификации лучевой терапии только 20-30 % больных раком простаты умирают от этого заболевания.
Исходя из выше сказанного следует, что молодые, больные раком простаты с ожидаемой продолжительностью жизни более 10 лет имеют значительно больший иск погибнуть от рака простаты и должны рассматриваться как кандидаты для агрессивных методов лечения: хирургического и лучевого.
Радикальная простатэктомия является лучшим методом лечения, так как обеспечивает более длительный безрецидивный период после лечения с одной стороны, а с другой стороны, несмотря на большее количество осложнений, лучше воспринимается пациентами с психологической точки зрения, как метод при котором «Рак удаляется из организма».
Хирургическое лечение, безусловно, в гораздо большей степени, при сравнении с лучевыми методами лечения связано с развитием импотенции, эректильной дисфункции, и недержания мочи.
Оба этих состояния важны для сохранения психологического здоровья, социальной адаптации «молодых» пациентов раком простаты, напомню, мы говорим о мужчинах младше 60 лет.
Эректильная дисфункция частая проблема, или осложнение, возникающая после радикальной простатэктомии. Несмотря на то, что до операции невозможно предсказать на 100% отсутствие поражения нервно-сосудистых пучков (НСП), а соответственно возможность восстановления эрекции после операции, по мнению некоторых авторов, заниматься решением этой проблемы, необходимо задолго до операции. Эректильная дисфункция развивается после РППЭ 20%-90% пациентов. Причин такого значительного различия в частоте возникновения этой проблемы множество. Основное это отсутствие стандартного подхода к решению возможных проблем, а конкретно к определению 3 основных вопросов: определение эректильной дисфункции, определение группы пациентов, заинтересованных в получении помощь по поводу этой проблемы и необъективность, информации получаемой от пациентов.
Необходимо отметить, что важным моментом стало широкое внедрение нервосберегающих операций. После широкого распространения этой техники удалось достигнуть почти 50% сохранения эректильной функции после РППЭ, данные приведены в таблице 1.
Таблица 1
| Исследователь | Средний возраст | Число пациентов | Период наблюдения | Частичная эрекция | Эрекция, достаточная для введения члена во влагалище с/без инг.5ФДЭ |
||
| Quilan 1991 | <50 | 29 | 18 |
|
90% | ||
| 50-59 | 141 | 18 | 14% | 82% | |||
| 60-69 | 112 | 18 | 21% | 69% | |||
| >70 | 9 | 18 | 22% | 22% | |||
| Leandri 1992 | 68 | 106 | 6/12 | 38%/15% | 30%/56% | ||
| Jonler 1994 | 64 | 93 | 22.5 | 38% | 9% | ||
| Walsh 2000 | 57 | 64 | 2.18 | не прим. | 73%/86% | ||
| Kundu 2004 | >50 | 125 | 18 | Не применимо | 93% | ||
| 50-59 | 675 | 18 | 85% | ||||
| 60-69 | 794 | 18 | 71% | ||||
| >70 | 176 | 18 | 52% |
Поэтому разработка новых программ реабилитации больных может способствовать улучшению качества их жизни, за счѐт большей вероятности восстановления эректильной функции после операции.
Появление новых технологий выполнения простатэктомии, лапароскопическая и роботассистированная, привело к улучшению функциональных результатов проведѐнной операции, о чѐм свидетельствует приведѐнная ниже информация (таблица 2)
Таблица 2 Сравнение частоты сохранения эрекции после различных способов выполнения простатэктомии (данные литературы)
|
|
Автор |
Возраст |
Количество пациентов |
Период наблюдения |
Частичная |
Эрекция |
|
«Открытая» простатэктомия |
Frazier et al 1992 |
65 |
22 |
12 |
н/о |
78% |
|
Ruiz-Deya et al 2001 |
62,9 |
54 |
18 |
н/о |
41% |
|
|
Harris 2003 |
65,8 |
12 |
6 |
83% |
25% |
|
|
Лапароскопическая простатэктомия |
Guillonne a(2002) |
70 |
47 |
4 |
85% |
74% |
|
Anastaisid is (2003) |
60 |
77 |
12 |
н/о |
81% |
|
|
Curto (2006) |
62,5 |
137 |
12 |
35% |
59% |
|
|
Роботассистированная простатэктомия |
Menon (2005) |
57,4 |
58 |
12 |
51% |
74% |
|
Joseph(20 06 |
60 |
129 |
6 |
н/о |
80% |
|
|
Kaul (2006) |
57 |
102 |
12 |
71% |
96% |
Наиболее важным моментом возникновения ЭД после простатэктомии, как уже было сказано, прежде всего, является повреждение кавернозных нервов во время простатэктомии (прямое повреждение, пересечение, или температурное при коагуляции). Но сохранность НСП является так же достаточно субъективным показателем, требующим объективизации.
Кроме этого существует вероятность «отсроченного» повреждения нерва, вследствие возникающего в зоне операции отѐка и воспаления. Возможность этого подтверждается данными о том, что у ряда пациентов эректильная функция восстанавливается, но пропадает через некоторое время после операции.
И вполне логичным представляются выводы о том, что одностороннее сохранение нервно-сосудистых пучков лучше, чем двустороннее повреждение, но хуже чем двустороннее сохранение, при котором велика вероятность спонтанного или медикаментозно (ингибиторы фосфодиэстеразы 5типа) индуцированного восстановления эрекции. Предлагаются различные способы объективизации этого параметра.
Другим последствием повреждения НСП, ухудшающим прогноз на восстановление эректильной функции, является нарушение эластичности гладкой мускулатуры и стимуляция апоптоза гладкомышечных и эндотелиальных клеток. Возможной причиной возникновение ЭД является повышение накопления коллагена, уменьшении эластичности полового члена, нарушение венозноокклюзионных механизмов. Отсутствие эрекции после операции вызывает уменьшение выработки простагландина Е1, с вытекающими отсюда последствиями (нарушение выработки профибриновых компонентов).

Кроме этого имеет место апоптоз клеток гладкой мускулатуры, возникающий под действием процитокинов (с-единица N-температурной киназы и р38 митоген активированной протеинкиназы), появляющихся при повреждении аксонов нервов. Нарушение целостности нервов ведет к апоптозу не только клеток мышечных волокон, но и эндотелиальных клеток.
Следующей причиной возникновения ЭД является повреждение артерий: добавочная срамная артерия. По мнению одних исследований наличие этих сосудов является залогом восстановления потенции в послеоперационном периоде, так как согласно ангиографическим исследования они являются основным источником кровоснабжения пениса во всех случаях, когда они обнаруживались и были сохранены. С другой стороны эти выводы не подтверждаются данными других исследователей. Не было обнаружено зависимости наличия этой артерии и частотой возникновения ЭД у 200 пациентов, подвергнутых роботассистированным простатэктомиям.
В среднем добавочная артерия определяется у 25% пациентов. У 10% пациентов она располагается по латеральной поверхности простаты, а у 13% эта артерия располагается в области верхушки простаты, проходя через волокна мышцы, поднимающую анус, а у приблизительно 2% пациентов была обнаружено обе разновидности добавочных сосудов.
Таким образом исходя перечисленных причин органического характера возникновения эректильной дисфункции выводится несколько путей профилактики и лечения, возникающего заболевания. Первый и самый очевидный, который подтверждается многими авторами, это совершенствование хирургической техники, ограничение или минимальное использование электрохирургического инструмента, либо выбор такового с минимальным воздействием на ткани, окружающие очаг воздействия электрокоагулятора.
Второй, в случае возникновения проблемы, а так же даже при отсутствии, по мнению пациента нарушений, но связанное с перенесенным вмешательством изменением ритма половой жизни, и необходимостью проведения профилактики необратимых изменений структуры пещеристых тел, медикаментозно стимулированная эрекция.
2010 Mulhall применял комбинацию препаратов силденафил и ПГЕ2.
Простагландин вводился после неэффективности силденафила.
Через 2 месяца терапии эффект отмечался у 58% пациентов, через 7 месяцев 30%.
Так же к методам лечения прибегали: локальное отрицательное давление, интрауретральные и интракавернозные введения вазоактивных препаратов.
2006 Raina лечил 109 больных. 50 ЛОД, 59 наблюдение. Через 9 месяцев отметил следующие результаты: эрекции достаточной для проведения полового акта, не спонтанная, отмечалась у 32% с ЛОД терапией и у 37% наблюдения. Аналогичные результаты получены Dalkin d 2007, Kohler 2007, Yuan 2010. (2123). Достоверного улучшения не было отмечено, но после ЛОД пациенты были готовы к половому акту, т.к. у них во время терапии достигалась эрекция.
2010 McCullough проводил исследование по сравнению эффективности ежедневного внутриуретрального введения альпростадила против 50-100 мг силденафила. 50 мг ежедневно и 100 мг перед предполагаемым сексом, но не менее 6 р/месяц. Исследование проводилось на протяжении 9 месяцев. 1 группа 139 человек, завершили 97, во второй группе 73 пациента, в завершении не было обнаружено разницы. Таблица. Показатели достижения средней эрекции или лучше чем средняя.
На сегодняшний день наиболее дискутабельным остаѐтся вопрос о времени назначения препарата.
Существует мнение о необходимости назначения ингибиторов ФДЭ5 до операции и продолжение их приѐма после.
Материалы и методы. В онкоурологическом отделении челябинского областного клинического онкологического диспансера за период с 2007 по 2015 год было прооперировано 273 пациента с диагнозом рак простаты. Распределение их по группам риска прогрессирования и рецидивирования заболевания, согласно общепринятой классификации, представлено в таблице 3.
Таблица 3. Характеристика пациентов
| Стадия | PSA | Индекс Глисона | Количество | |
| Группа низкого риска | Т 1 -2а | < 10 нг/мл | <6 | 45 |
| Группа среднего риска | Т2Ь-2с | 10-20 нг/мл | 7 | 140 |
| Группа высокого риска | ТЗа | >20 нг/мл | 08.окт | 54 |
| Группа очень высокого риска | ТЗЬ-4 | >20 нг/мл | 08.окт | 34 |
| Итого: | 273 |
Как видно из таблицы хирургическое лечение выполнялось нами на всех стадиях онкологического процесса. Естественно при выборе метода лечения мы руководствовались общепринятыми рекомендациями, основываясь на целесообразности выполнения операции каждому конкретному пациенту. Сложность выбора метода лечения в нашей клинике заключается ещѐ и в том, что нам доступны практически все из существующих методов лучевого лечения: низкодозная брахитерапия, конформная дистанционная гамматерапия, система «Кибернож»
Выбор именно хирургического варианта лечения основывался на следующих основных моментах: отсутствие медицинских противопоказаний для хирургического вмешательства, отсутствие признаков местного распространения опухолевого процесса, возраст пациента, категорический отказ от лучевых методов лечения.
Таким образом «прямыми» кандидатами для простатэктомии мы относили пациентов, относящихся к группам низкого и среднего рисков прогрессирования заболевания. Появление пациентов из групп высокого и очень высокого риска связанно в основном с послеоперационными находками, при отсутствии до операции указаний на распространение опухолевого процесса за пределы капсулы простаты или на семенные пузырьки, но при гистологическом исследования удалѐнной простаты стадия заболевания менялась. В случае оцениваемого нами неблагоприятного прогноза, при отсутствии иных противопоказаний, сопутствующей патологии и сомнительных данных дополнительных методов исследования, оценивавших местное распространение процесса и наличие метастатического поражения регионарных лимфоузлов, но настоятельном желании пациента в выполнении простатэктомии мы проводили неоадъювантную гормонотерапию на протяжении 2-3 месяцев. Исходя из наших наблюдений, мы ни разу не обнаружили после операции метастатического поражения лимфоузлов, в случае сомнительных данных КТ/МРТ органов малого таза не до не совсем согласующихся с другими прогностическими критериями. Чаще всего мы наблюдали обратную ситуацию, когда при отсутствии каких либо достоверных данных за возможность поражения лимфоузлов, обнаруживались метастазы при гистологическом исследовании.
Мы провели анализ общей и онкоспецифической выживаемости пациентов, оперированных в нашей клинике в период с 2007 по 2014 годы.
Результаты нашего лечения представлены на рисунках 1 (общая выживаемость) и 2 (общая выживаемость в группах низкого и среднего рисков) 3 (безПСА рецидивная выживаемость в группе низкого и среднего риска) и прилагаемых к ним таблицах.
Данные представленные в таблицах свидетельствуют о достаточно высоких положительных онкологических результатах. Анализ в целом удовлетворительных показателей выживаемости и возникновения рецидивов привѐл нас к выводу о необходимости введения в нашу практику мероприятий, направленных на улучшение качества жизни пациентов в послеоперационном периоде.
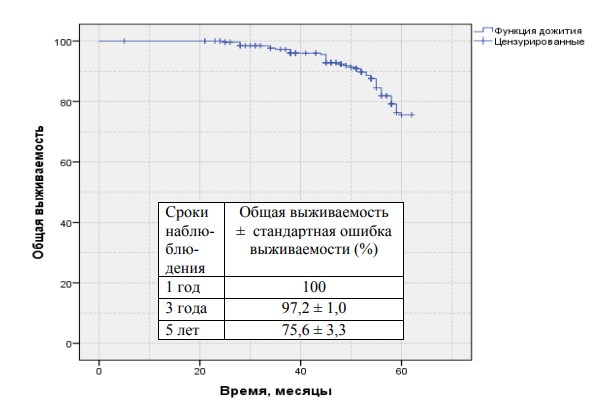
Рис.1.
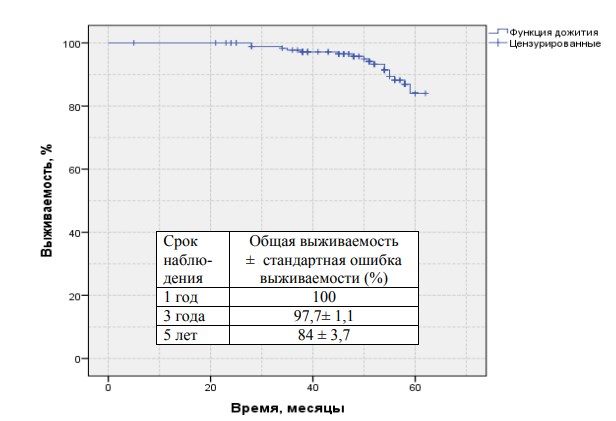
Рис.2.
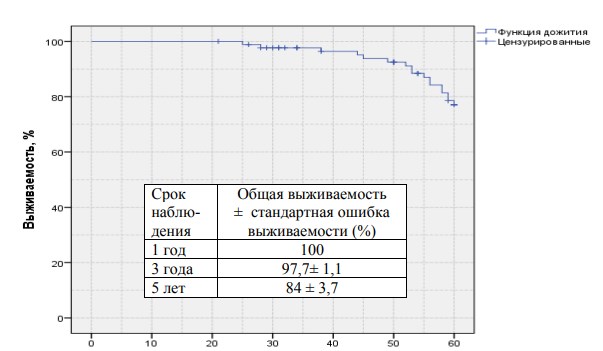
Рис.3. БезПСАрецидивная выживаемость для низкого и среднего риска
Всем пациентам перед операцией с целью оценки эректильной функции проводился опрос по шкале МИЭФ-5. Пациенты с выраженными нарушениями эректильной функции до операции не рассматривались нами как кандидаты на проведение консервативной терапии, направленной на восстановление потенции. В период с 2012 по 2015 годы мы проводили анализ степени заинтересованности сохранения эректильной функции у наших пациентов, степень выраженности симптомов эректильной дисфункции до операции. В послеоперационном периоде в течение 1 месяца мы оценивали состояние эректильной функции.
Критериями включения в наше исследование были следующие факторы: сохранение, визуально, сосудистонервного пучка минимум с одной стороны, отсутствие необходимости назначения адъювантной гормональной терапии, желание пациента на проведение лечебно-диагностических мероприятий, направленных на восстановление эректильной функции.
Вне зависимости от состояния эректильной функции после операции после удаления уретрального мы рекомендовали приѐм ежедневный приѐм тадалафила в дозе 5 мг.
Через две недели после начала приѐма мы оценивали результаты. В том случае если суммарный балл по шкале МИЭФ5 после операции значительно отличался от такового до операции мы проводили следующие варианты лечения: немедленное назначение ингибиторов ФДЭ5, внутрикавернозные инъекции, ЛОД-терапия в сочетании с препаратами тестостерона. результаты проведѐнной нами терапии представлены в таблице.
Таблица 4 Преди послеоперационная оценка эректильной функции у пациентов, перенесших простатэктомию.
| Балл МИЭФ5 до операции | Балл МИЭФ5 после операции | ||||||||||||
| Без стимуляции после вводного курса | Тадалафил 5 мг/20 мг | Внутрикавсрнозные инъекции | лод-терапия+препараты тестостерона | ||||||||||
| Человек | Балл МИ- *1>5 | Человек | Балл МИ- ЭФ5 | Эффективность <%) | Чел©- век | Балл МИ- ЭФ5 | 'Эффективность <%) | Человек | Балл МИ- ЭФ5 | Эффективность <%) | Чело- век | Балл МИ- ЭФ5 | Эффективность <%) |
| 84 | 22± 0,3 | 27 | 19± 0,9 | 24% | 42 | 17± 1,2 | 54,80% | 5(2) | 18± 0,6 | 40% | 10 (7) | 19± 0,7 | 70% |
Выбор варианта стимуляции был случайным и основывался чаще всего на личных предпочтениях пациентов, изъявленных ими после информирования о возможных методах лечения. В данной таблице представлены результаты лечения в монорежиме. То есть эффективность того или иного метода лечения, выбранного случай но в качестве начального. Естественно, что в случае получения отрицательного результата, после беседы с пациентом назначался иной из существующих и доступных способов терапии. Троим из тех пациентов, у которых консервативные мероприятия оказались не эффективными было выполнено протезирование полового члена.
Положительным результатом нашего лечения мы считали те ситуации, когда балл МИЭФ5 приближался к предоперационному и положительной субъективной оценке эффективности проведения терапии со стороны пациента.
Мы обнаружили высокую эффективность применения ЛОД-терапии. но необходимо учитывать, что физиолечение мы сочетали с применением препаратов экзогенного тестостерона. Этот факт накладывает большие ограничение на этот метод лечения и требует тщательного отбора пациентов, которым возможно его предложить.
Вывод. По нашему мнению послеоперационные результаты после РППЭ чаще всего являются индивидуальными для каждой клиники. Исходя из истории происхождения заболевания, влияние на результаты лечения, как онкологические, так и функциональные, оказывают многочисленные факторы. Самым главным является технический: максимальное сохранение сосудистонервных пучков, определение ситуации, когда допустимо выполнение нервосберегающей операции. Другим важнейшим фактором является создание структуры наблюдения за пациентами и помощи им в случае наличия каких-либо нежелательных, или не оговариваемых на дооперационном этапе, нежелательных последствий после операции. Неоспоримыми факторами, влияющими на исход операции и качество, оказываемой помощи пациентам после, является количество пациентов, находящихся под наблюдением до, во время и после операции. В настоящее время до сих пор процесс наблюдения за этими пациентами решѐн, но коррекция возникающих у человека социальных проблем: эректильная дисфункция и недержание мочи, при достигнутом онкологическом результате, остаѐтся вопросом дискуссии. Не только в части общепринятых и утверждѐнных алгоритмов и схем лечения, но и того, кто этим должен заниматься урологи общей практики или онкоурологии.
Литература
1. Gleason, D. F.: Histologic grading and clinical staging of prostatic carcinoma. In: Urologic Pathology: The Prostate. Edited by M. Tannenbaum. Philadelphia: Lea and Febiger, chapt. 9, pp. 171–197, 1977
2. McCammon, K. A., Kolm, P., Main, B. et al: Comparative quality-of-life analysis after radical prostatectomy or external beam radiation for localized prostate cancer. Urology, 54: 509, 1999
3. Walsh, P. C.: Anatomic radical prostatectomy: evolution of the surgical technique. J Urol, 160: 2418, 1998
4. Schover, L. R., Fouladi, R. T., Warneke, C. L., Neese, L., Klein, E. A., Zippe, C. et al: Defining sexual outcomes after treatment for localized prostate carcinoma. Cancer, 95: 1773,2002
5. Kundu, S. D., Roehl, K. A., Eggener, S. E., Antenor, J. A., Han, M. and Catalona, W. J.: Potency, continence and complications in 3,477 consecutive radical retropubic prostatectomies. J Urol, 172: 2227, 2004
6. Su, L. M., Link, R. E., Bhayani, S. B., Sullivan, W. and Pavlovich, C. P.: Nerve-sparing laparoscopic radical prostatectomy: replicating the open surgical technique. Urology, 64: 123, 2004
7. Efficacy and safety of transurethral alprostadil in patients with erectile dysfunction following radical prostatectomy. J Urol. 160: 1326-1328, 1998
8. Gold, L., Clark W: Systematic review of randomized controlled trials of sildenafil (Viagra) in the treatment of male erectile dysfunction. Br J Gen Pract 2001; 51: 1004.
Статья опубликована в журнале "Вестник урологии". Номер №4/2015 стр. 50-64









Комментарии