Алчинбаев М.К., Макажанов М.А., Тулеева Л.Н.
АО «Научный центр урологии имени академика Б.У.Джарбусынова», г.Алматы, Республика Казахстан 050060, Республика Казахстан, г.Алматы, ул.Басенова, 2Т, тел. (727)3378493 Эл.почта: nc_urol@mail.ru, alchinbaev_mk@mail.ru, makazhanov.marat@mail.ru, lazzattul@mail.ru
Актуальность. Проблема бесплодия остается одной из актуальных в современной медицине, так как частота бесплодия брака составляет 15–16% в общей популяции супружеских пар [1]. Этот показатель продолжает расти и приблизительно в 40-50% случаев причинные факторы бесплодия являются мужскими [2]. Зачастую нарушения репродуктивной функции у мужчин связаны с изменениями в выработке спермы, нарушениям сперматозоидов, а также с их транспортом. Приблизительно у 70-75% мужчин с нарушениями в выработке спермы не удается установить причину бесплодия [3].
Известно, что сперматогенез – это многостадийный сложный процесс, который регулируется гормонами гипоталамогипофизарной систем и половых желез, поэтому бесспорно одним из первых этапов при постановке диагноза «мужское бесплодие» является исследование уровня гормонов [4-6]. Однако в последние годы в исследованиях по проблеме бесплодия большое внимание уделяется генетическому аспекту нарушения репродуктивных функций, так как от экспрессии определенных регуляторных генов зависит течение того или иного звена каскада физиологических, биохимических процессов образования сперматозоидов [7-9].
В ряде работ показано, что определенную роль при мужском бесплодии играет наличие хромосомных аномалий, которые выявить при стандартных диагностических методах анализа спермы не представляется возможным [10-11]. С развитием таких цитогенетических методов как методы флуоресцентной гибридизации (FISH) появилась возможность исследовать связь между проявлениями патоспермии и хромосомных анеуплоидий в ядрах сперматозоидов человека [12-13]. Среди мужчин с бесплодием и нарушением сперматогенеза у 515% обнаруживают хромосомные нарушения, аномалии гоносом составляют 75%, аутосом – 25% [14].
Целью наших исследований явилось проведение анализа корреляции хромосомных аберраций, а также фрагментации ДНК и различных проявлений нарушения сперматогенеза.
Материалы и методы. В ходе работы было проведено исследование 58 образцов спермы мужчин с диагнозом бесплодие и 23 условно здоровых фертильных мужчин. Все пациенты подписали согласие на добровольное участие в научном исследовании. Возраст обследованных пациентов варьировал от 28 до 45 лет и в среднем составил в основной группе 33,06±0,44 года, в контрольной группе – 32,30±1,11 года (р>0,05).
В ходе исследования проводили анализы спермы на подвижность, концентрацию и морфологию по строгим критериям Крюгера (ВОЗ 2010). Для сбора спермы пациент должен был воздержаться от эякуляции не менее 3дней и получить сперму путем мастурбации. Образец спермы помещали в термостат для полного разжижения, время разжижения отмечали. Оценка параметров спермы, таких как подвижность, концентрация и морфология, проводили с помощью автоматической программы «Видео-тест сперм 3.2» производства ООО «Видеотест», г. Санкт-Петербург, Россия. Для этого 10-20 мкл разжиженной спермы загружали в камеру Маклера, покрывали стеклом и анализировали при увеличении х20. Морфологию сперматозоидов проводили на обработанных отмытых сперматозоидах, окрашенных по методу Diff-Quick. С помощью автоматической программы производили расчет соотношения сперматозоидов, принадлежащих к классам норма и патология, процентного соотношения дефектов головки, шеи и хвоста и автоматический расчет индекса аномалий MAI (индекс множественных аномалий), TZI (индекс тератозооспермии), SDI (индекс деформации спермы).
Фрагментацию ДНК спермы исследовали методом SCD (spermchromatindipersion, Spermprocessor, India) с использованием флуоресцентного микроскопа Axioscope 40. Расчет индекса фрагментации ДНК проводили в 500 клетках. Для исследования хромосомных аномалий в ядрах сперматозоидов по Х, Y, 18 и 21 хромосомам применяли метод флуоресцентной гибридизации in situ с использованием флуоресцентных ДНК-зондов (Vysis Multi Vision PGT, Abbot Molecular).
Статистическая обработка данных проводилась с учетом критерия Фишера-Стьюдента при помощи программы GraphPadPrism 6.0 (GraphPad SoftWare, SanDiego, CA) Результаты считались достоверными при значении p<0,05.
Результаты и обсуждение. Нами проведено исследование эякулята 58 мужчин (28,4%) с инфертильностью в браке и 23 (71,6%) условно здоровых фертильных мужчин. На рисунке 1 приведены результаты анализа спермограммы мужчин, страдающих патоспермией.
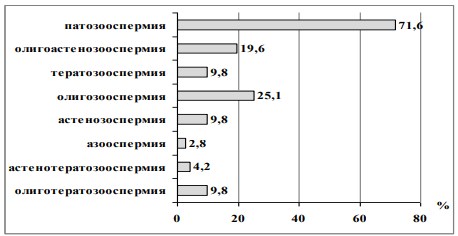
Рис. 1. Виды патоспермии у пациентов с бесплодием в браке
У всех мужчин имели место различные проявления патоспермии.
В таблице 1 приведены результаты определения индекса множественных аномалий (ИМА) и индекса дефекта спермы (ИДС). При таких видах патоспермии как астенозооспермия, олигозооспермия, олигоастенозооспермия индексы, характеризующие степень аномалии в морфологии сперматозоидов, не превышают нормативных величин, тогда как при тератозооспермии, олиготератозооспермии и астенотератозооспермии значения данных индексов превышают референсные значения практически в 1,5 раза.
При исследовании клеток на наличие фрагментаций ДНК ядер выявлено, что большая степень фрагментации генетического аппарата отмечается при астенозооспермии, уровень фрагментации составляет 46,0%±5,3 (р=0,01), при астенотератозооспермии 45,2%±7,2 (р=0,009) и при олигоастенозооспермии 42,1%±8,5 (р=0,003) соответственно.
Степень фрагментации ядерного ДНК сперматозоидов при олиготератозооспермии составила 36,5%±3,5 (р=0,007), олигозооспермии 33%± 6,2 (р=0,009) и тератозооспермии 31%±4,2 (р=0,02) (рис. 2). В группе здоровых пациентов степень фрагментации ДНК не превышала референсных значений (в норме до 15%) и составила 8%±2,5 (р=0,008).
Таблица 1. Хромосомные аномалии
| Разновидность патоспермии | Индекс множественных аномалий (ИМА), референсные значения менее 1,6 | Индекс дефекта сперматозоидов (ИДС), референсные значения менее 1,6 |
| Астенозооспермия | 1,5±0,58* | 1,58±0,5** |
| Олигозооспермия | 1,43±0,2** | 1,25±0,14** |
| Тератозооспермия | 2,82±0,4* | 1,95±0,16* |
| Олигоастенозооспермия | 1,0±0,38*** | 0,8±0,23* |
| Олиготератозооспермия | 1,92±0,29* | 2,5±0,38** |
| Астенотератозооспермия | 2,0±0,18* | 1,9±0,17* |
| Нормозооспермия | 0,3±0,15* | 0,5±0,08** |
Данные выражены как среднее значение ± стандартное отклонение, *р<0,05, **р<0,005, ***р<0,001
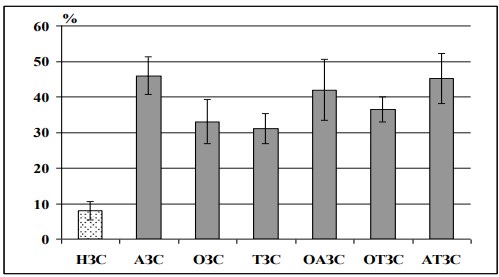
Рис. 2. Степень фрагментации ДНК ядер сперматозоидов По оси абсцисс: степень фрагментации (%), по оси ординат: группы пациентовАЗС астенозооспермия, ОЗС олигозооспермия, ТЗС тератозооспермия, ОАЗС олигоастенозооспермия, ОТЗС олиготератозооспермия, АТЗС астенотератозооспермия, НЗС нормозооспермия.
На следующем этапе исследования был проведен молекулярноцитогенетический анализ методом флюоресцентной гибридизации, в результате которого выявлено, что средний уровень анеуплоидий у мужчин с нормозооспермией составил 0,11%±0,06 (р=0,003), тогда как в случаях с патоспермией значение названного показателя варьировало от 2,11% до 2,9% (р=0,014) при референсных значениях – ≤0,25%.
В результате анализа числа хромосом в ядрах сперматозоидов у пациентов с различными видами патоспермии выявлены аномалии набора хромосом в половых клетках (рис. 3).
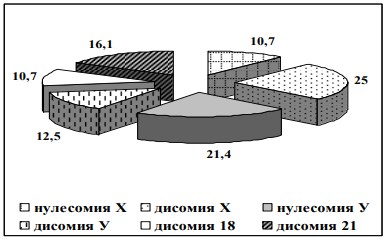
Рис.3. Частота (%) и характер анеуплоидий сперматозоидов
Большая доля хромосомных аберраций при патоспермии проявляется в виде дисомии по хромосоме Х и нулесомии хромосомы У, их частота составила 25% и 21,4% случаев от общего количества нарушений в расхождении хромосом.
В таблице 2 представлен более детальный анализ частоты проявлений различных типов анеуплоидий сперматозоидов при разных видах патоспермии. Как показали результаты исследования,наличие различных видов хромосомных отклонений более часто встречается при олигозооспермии по сравнению с другими вариантами патологии.
Таблица 2. Частота и характер количественных нарушений в наборе хромосом сперматозоидов
| Вариант патологии | Распределение хромосомных аномалий в группе пациентов с диагнозом бесплодие, % | |||||
| АЗС | ОЗС | ТЗС | ОАЗС | ОТЗС | АТЗС | |
| нулесомия Х | 0 | 5,4 | 1,8 | 3,6 | 0 | 0 |
| дисомия Х | 1,8 | 8,9 | 3,6 | 7,1 | 3,6 | 0 |
| нулесомия У | 3,6 | 7,1 | 3,6 | 5,4 | 1,8 | 0 |
| дисомия У | 1,8 | 1,8 | 3,6 | 3,6 | 1,8 | 0 |
| дисомия 18 | 3,6 | 3,6 | 0,0 | 1,8 | 1,8 | 3,6 |
| дисомия 21 | 1,8 | 5,4 | 0,0 | 3,6 | 3,6 | 1,8 |
Таким образом в ходе проведенных исследований выявлено, что зачастую в основе механизмов нарушения мужской фертильности при анормальных основных показателях спермограммы лежат изменения на молекулярногенетическом уровне, а именно нарушения целостности генетического материала и изменения в количестве хромосом, что не может не сказаться на течении процессов сперматогенеза.
Литература
1. Локшин В.Н. Организация специализированной помощи супружеским парам с бесплодием в Республике Казахстан // Материалы XX ежегодной международной конференции РАРЧ «Репродуктивные технологии сегодня и завтра» Нижний Новгород, 2010.-29c.
2. Wang R.X. , Fu C., e.a. Male infertility in China: laboratory finding for AZF microdeletions and chromosomal abnormalities in infertile men from Northeastern China // J Assist Reprod Genet. 2010 Jul; 27(7): 391–396р.
3. Денисенко С.В., Дарий А.С. Кононенко М.И., Зерова-Любимова Т.Э. Генетика репродукции.Киев: Ферзь-ТА, 2008. 652 с.
4. Sofikitis N., Giotitsas N., Tsounapi P., Baltogiannis D., Giannakis D., Pardalidis N.Hormonal regulation of spermatogenesis and spermiogenesis.//J Steroid Biochem Mol Biol. 2008 Apr;109(3-5).-323-30р.
5. O'Shaughnessy P.J. Hormonal control of germ cell development and spermatogenesis.//Semin Cell Dev Biol. 2014.-55-65р.
6. Mushtaq M, Jafri S.A., SheikhA.S., e.a.Human Chorionic Gonadotropin (hCG): A treatment of oligospermia // Pak J Med Sci 2007 (Part-II).Vol. 23 No. 6.P:840-846с.
7. Ge SQ1, Kang XJ, Liu GR, Mu SM.Genes involved in spermatogenesis // Yi Chuan. 2008 .-3-12р.
8. Diemer T., Desjardins C. Developmental and genetic disorders in spermatogenesis// Human Reproduction Update 1999, Vol. 5, No. 2 pp.120–140р.
9. Yu Z., Guo R., Ge Y., е.а. Gene expression profiles in different stages of mouse spermatogenic cells during spermatogenesis //Biol Reprod. 2003 Jul;69(1):3747р.
10. HwangK., WeedinJ. W., Lamb D. J. The use of fluorescent in situ hybridization in male infertility//Ther Adv Urol. 2010 Aug; 2(4).157–169р.
11. FerlinA.Male infertility: role of genetic background // Reproductive BioMedicine .-Vol 14. No 6. 2007.734-745с.
12. ShamsiM. B., KumarK., DadaR. Genetic and epigenetic factors: Role in male infertility//Indian J Urol. 2011 Jan-Mar; 27(1).110–120р.
13. Jordan R., Edington J., Evans H.H., Schwartz J.L. Detection of chromosome aberrations by FISH as a function of cell division cycle (harlequin-FISH).// Biotechniques. 1999 Mar;26(3).-532-4р.
14. Barakat A.I., Seikaly M.G., Kaloustian V.M. Urogenital abnormalities in genetic diseases.// J of Urology 1986.-778 — 785р.
Статья опубликована в журнале "Вестник урологии" №2 2016, стр. 5-12









Комментарии