
Коршунов М.Н.
К.м.н., доцент кафедры урологии ФГБУ ДПО «ЦГМА» Управление делами Президента РФ (г. Москва).
На сегодняшний день средняя продолжительность жизни пациентов с впервые выявленными опухолями значимо удлинилась, увеличился и возраст пациентов, которые планируют детей — как первичное, так и вторичное отцовство.
Как подчеркнул Максим Николаевич, в практике врача такие пациенты — не самая большая когорта, их доля составляет 2–3% от общего числа. В ряде случаев за помощью обращаются мужчины с тяжелыми нарушениями фертильности на фоне онкологических заболеваний, и им помочь напрямую нельзя. Однако и здесь в ряде случаев доступной остается опция криоконсервации.
В наши дни частота выявления рака яичек значимо увеличивается, кривая выявляемости неуклонно стремится вверх. Риск онкологических заболеваний касается не только взрослых, но также детей и подростков. Применение современных методик противораковой терапии приводит к увеличению средней продолжительности жизни пациентов, при этом прогноз сохранности гематогенеза при противоопухолевом лечении, сроки восстановления фертильности и оценка возможных рисков генетических пороков у потомства представляются особо важными.
Онкориск у детей и подростков
В литературе показано, что риск рождения детей с предрасположенностью к онкологическим заболеваниям крови у людей старшей возрастной группы, особенно с применением вспомогательных репродуктивных технологий (ВРТ), значимо увеличивается. Таким образом, растет популяция детей, которые имеют склонность к раковым заболеваниям, что подразумевает достаточно агрессивное лечение. В дальнейшем эти дети станут взрослыми мужчинами и станут планировать потомство, что существенно обостряет актуальность проблемы.
В наше время скандинавские страны плотно занимаются вопросом крио-консервирования тестикулярной ткани у детей и подростков в возрасте 5–11 лет. Эта программа направлена на то, чтобы в дальнейшем из стволовых клеток можно было вырастить здоровые сперматозоиды. Это инновационная технология, тем не менее скандинавские страны, которые на сегодняшний день являются лидерами по числу онкологических заболеваний репродуктивной системы, занимаются вопросами сохранения репродуктивной функции у таких пациентов.
Механизмы нарушения сперматогенеза после химиотерапии
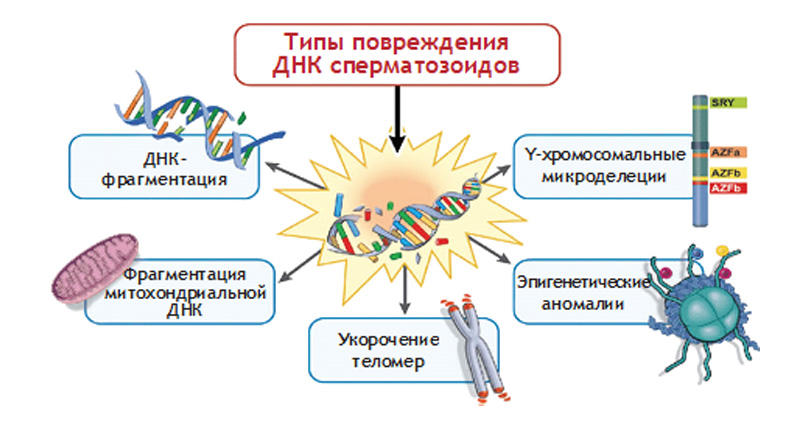
Говоря о механизмах нарушения сперматогенеза, в частности при лучевой и химиотерапии, нужно иметь в виду, что механизмы могут быть как прямыми, так и опосредованными: цитотоксический эффект радиационной и химиотерапии непосредственно за счет повреждения герменативного эпителия и нарушение фертильности вследствие поражения гипоталамо-гипофизарной оси. Стволовые клетки сперматогенеза менее чувствительны к токсической терапии, то есть цитотоксический эффект может и не проявляться на уровне стволовых клеток. Говоря о более поздних стадиях сперматогенеза (мейоз и спермиогенез), можно отметить, что здесь чувствительность клеток значительно возрастает. Клетки Лейдига и Сертоли не проходят процесс пролиферации, и для того чтобы произошло тяжелое повреждение, необходимо достаточно выраженное негативное влияние на них. Тем не менее, эти клетки тоже подвержены воздействию цитотоксической терапии.
Как правило, уже через месяц после начала химиотерапии можно увидеть у пациента азооспермию. В среднем цикл сперматогенеза равен 3 месяцам, но блок может наступить уже на уровне мейоза — через месяц-полтора. Кроме того, безусловно важной является продолжительность и степень токсической терапии, которая направлена на лечение онкологического заболевания. Прогноз и будущий репродуктивный потенциал мужчины при этом будет напрямую зависеть от сохранности сперматогенного эпителия.
Механизмы нарушения сперматогенеза при лучевой терапии
При лучевой терапии все зависит от экспозиции и лучевой нагрузки, дозы и локальности воздействия. Самые сложные случаи наблюдаются, когда лучевая терапия локализована в области яичек или малого таза. Если доза тестикулярного облучения превышает 2,5 Гр — как правило, развивается постоянная азооспермия: у пациента не будет сперматозоидов в эякуляте. Высокие нагрузки сопровождаются уже необратимой азооспермией без возможности выполнения микро TESE: будет крайне низка вероятность нахождения сперматозоидов.
При опухолях головного мозга и высокой лучевой нагрузке мы можем встречаться с повреждением гипоталамо-гипофизарной оси. Соответственно, у пациента будет низкий уровень гонадотропинов, а яички перестанут работать в связи с тем, что прекратят получать стимулирующие направление импульсы от головного мозга. Здесь пациенту можно порекомендовать либо создать банк спермы перед проведением терапии, либо использовать гонадотропины — на их применение ожидается достаточно хороший ответ при проведении химиотерапии.
Прогнозирование восстановления сперматогенеза
Достаточно сложно спрогнозировать степень повреждения сперматогенеза при проведении химиотерапии. Если пациенту проводилось менее двух циклов химиотерапии, можно рассчитывать на возвращение сперматогенеза. Как правило, это пациенты в возрасте 24–30 лет, которые прошли курсы химиотерапии — чаще всего с болезнью Ходжкина. У пациентов после трех курсов химиотерапии найти сперматозоиды уже гораздо сложнее. К сожалению, достаточно высокие химические нагрузки вызывают необратимые изменения сперматогенеза, и здесь мы встречаемся с синдромом клеток Сертоли. Изменения могут носить временный либо пролонгированный характер: если у пациента в течение двух лет после проведения химиотерапии не находится сперматозоидов — рассчитывать на появление их в ближайшем будущем нельзя.
Таким образом, химиотерапевты при общении с пациентами должны информировать о низких, промежуточных либо высоких рисках нарушения сперматогенеза в зависимости от вида препарата и длительности терапии.
Возможно нахождение сохранных сперматозоидов после химиотерапии, однако в течение как минимум трех лет после ее проведения не рекомендуется планировать беременность, будь то самостоятельная беременность или достигнутая с использованием методов ВРТ. В этом случае достаточно высоки риски анэуплоидии в стволовых клетках, так что мы можем встречаться с потерями беременности либо с рождением детей со многими заболеваниями. Об этом также должны информировать пациентов химиотерапевты.
Отдельно может рассматриваться забрюшинная лимфаденэктомия. Специфический риск представляют онкологические заболевания полового члена и рак яичка. В конечном итоге решение о выполнении забрюшинной лимфаденэктомии принимают онкологи и онкоурологи, однако нужно помнить, что при выполнении данного оперативного пособия есть риск вызвать у пациента нарушение эякуляции — ретроградную эякуляцию либо анэякуляцию. К таким последствиям приводит симпатэктомия в 0–15% случаев. В подобных ситуациях пациент может рассчитывать на отцовство, но опять же с помощью методов ВРТ.
В заключение Максим Николаевич напомнил, что роль уролога, онколога и химиотерапевта должна быть не только в обеспечении долгожительства пациентов. Помимо этого, нужно понимать, что пациенты, излечившись, живут дальше и многие из них планируют обзавестись потомством. Давать правильные и своевременные рекомендации в этом отношении — проявление не только профессионализма, но и эмпатии по отношению к данной когорте пациентов.
Материал подготовила Ю.Г. Болдырева









Комментарии