Галлямов Э.А., Сорокин Н.И., Синицын В.Е., Мершина Е.А., Никогосян Р.А., Лисицкая М.В., Плотникова М.Л., Стригунов А.А., Нестерова О.Ю., Камалов А.А.
Медицинский научно-образовательный центр Московского государственного университета имени М.В. Ломоносова, Москва
Введение
Согласно данным Всемирной организации здравоохранения, онкологические заболевания на сегодняшний день являются одной из ведущих причин смертности во всем мире. В 2020 году от онкологических заболеваний умерло почти 10 млн человек, что сопоставимо с населением Чехии или Португалии [1]. Этот факт подчеркивает огромную актуальность проблемы.
Одним из часто встречающихся онкологических заболеваний в урологической практике является рак почки. По данным регистра Cancer Today, рак почки в структуре распространённости и смертности от онкологических заболеваний занимает 16-е место и 17-е место в мире соответственно. Ежегодно в мире регистрируется более 400 тысяч случаев рака почки, в то время как смертность достигает 180 тысяч в год [2]. При этом для мужчин заболевание оказывается более фатальным, чем для женщин. Согласно данным В.Б. Матвеева рак почки составляет около 5% в структуре онкологической заболеваемости среди мужчин и 3% среди женщин [3].
Рак почки является актуальной проблемой и для нашей страны. Так, в России ежегодно выявляется более 23000 новых случаев рака почки, среди которых на I и II стадию заболевания приходится 47,9% и 16% случаев, соответственно, а на III и IV стадии – 15,5% и 19,1%, соответственно. Частота летальных исходов в течении первого года с момента постановки диагноза рака почки в Российской Федерации по данным на 2014 год составила 17,6%, что подчеркивает необходимость ранней диагностики заболевания и его точной дифференциальной диагностики с доброкачественными образованиями почек [4].
Основным методами диагностики новообразований почки являются ультразвуковое исследование (УЗИ) и компьютерная томография (КТ) органов брюшной полости забрюшинного пространства с внутривенным контрастированием, а также магнитно-резонасная томография (МРТ). КТ является одной из самых точных, быстрых и методов диагностики. Существуют различные варианты методик выполнения КТ. Одной из наиболее перспективных является двухэнергетическая КТ (ДЭКТ). Она может предоставить преимущества в дифференциации доброкачественых и злокачественных объемных образований [5].
Физические методы, лежащие в основе взаимодействия рентгеновского излучения с веществом и обеспечивающие проведение двухэнергетической КТ – это фотоэффект, эффект Комптона и рассеяние Томсона. Основной принцип ДЭКТ базируется на том, что различные анатомические структуры и ткани могут иметь разную плотность в зависимости от используемой энергии рентгеновского излучения, под воздействием которой они находятся (в диапазоне между высокими и низкими значениями кВт) [6].
Ключевым преимуществом использования ДЭКТ является возможность так называемой декомпозиции, то есть количественной оценки содержания в исследуемых тканях различных элементов и веществ, в частности, йода (в составе контрастного вещества) кальция, мочевой кислоты, жира и воды. Благодаря этому, становится возможным выполнять построение виртуальных неконтрастных изображений, вычитание костных структур из изображений, построение так называемых «йодных карт» с получением изображений, отражающих количественное содержание йода (после контратсирования) в различных органах, тканях и очагах [7].
Сам метод ДЭКТ получил известность ещё на заре эры КТ, однако его применение было ограничено преимущественно оценкой минеральной плотности костной ткани. Сравнительно недавно (с 2006 г.) в клиническую практику обследования пациентов, страдающих злокачественными новообразованиями (в частности, с опухолями почек), начали внедрять ДЭКТ. Для этого метода используют либо сканеры с двумя источниками излучения, либо применяют быстрое переключение силы тока на рентгеновской трубке томографа в процессе сканирования, или же применяют двуслойные системы детекторов [6, 7].
Ниже приводится наше собственное клиническое наблюдение обследования пациента со случайно выявленным новообразованием почки, которому выполнялось ДЭКТ с целью уточнения структуры новообразования.
Клиническое наблюдение
Пациент Г., 70 лет. Обратился в МНОЦ МГУ с жалобами на затруднённое учащённое мочеиспускание как в дневное, так и в ночное время. Вышеуказанные жалобы беспокоили пациента с 2018 г. При обследовании в августе 2020 г. впервые было выявлено повышение простатспецифического антигена (ПСА) до 13 нг/мл, индекс ПСА 14%. Во время амбулаторного приёма при выполнении пальцевого ректального исследования пальпировалась увеличенная предстательная железа. На основании данных объективного осмотра область почек была без особенностей, почки не пальпировались, симптом «поколачивания» по поясничной области отрицательный. Из сопутствующих заболеваний у пациента был выявлен хронический гастрит, вне обострения; гипертоническая болезнь 2 стадии.
При дальнейшем обследовании направленного на выявление возможных очагов рака предстательной железы, при УЗИ простаты были выявлены признаки доброкачественной гиперплазии простаты (ДГПЖ) с умеренным внутрипузырным ростом, размеры железы 62 х59х58 мм, ее объем 109,3 см3, в периферической зоне в латеральной верхушке справа определялось очаговое гипоэхогенное образование с распространением на транзиторную зону, подозрительное на злокачественное. Пациенту было рекомендовано выполнение биопсии. По результатам трансректальной мультифокальной биопсии предстательной железы была вывялена стромально-железистая ее гиперплазия без признаков злокачественных изменений. На основании этого было принято решение о необходимости выполнения оперативного вмешательства в объёме лазерной энуклеации узлов ДГПЖ. В рамках предоперационной подготовки пациенту было выполнено УЗИ органов брюшной полости, где в структуре левой почки было обнаружено неоднородное многоузловое объемное образование размерами 100х90 мм. С целью уточнения природы и локализации новообразования было рекомендовано выполнение КТ почек и органов брюшной полости (ОБП) с внутривенным контрастированием.
КТ ОБП была выполнена на двухтрубочном компьютерном томографе экспертного класса Somatom Drive (Siemens Medical Solutions, Forchheim, Германия), с автоматическим выбором напряжения трубки и модуляцией тока на трубки на основе затухания (эталонное напряжение и ток трубки: 80 кВ, 300 mAS) в двух режимах: контрастной КТ с одним источником излучения и в режиме ДЭКТ (для более точной диагностики).
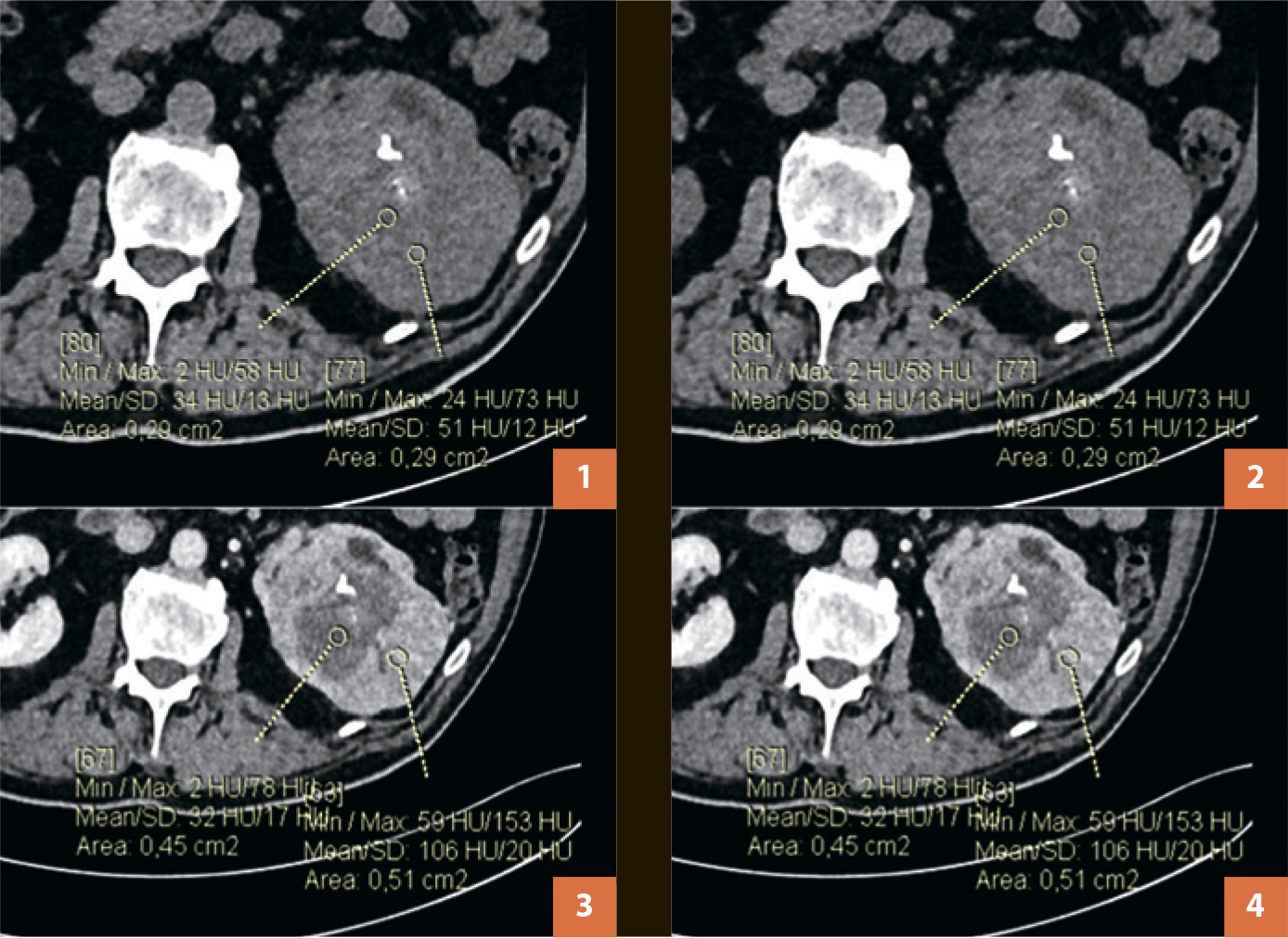
Рис. 1. КТ ОБП с многофазным внутривенным контрастированием, опухоль левой
почки, аксиальные срезы. (1) – нативная фаза, (2) – артериальная фаза, (3) – венозная
фаза, (4) – выделительная фаза.
По результатам КТ с внутривенным контрастированием (рис. 1) в левой почке было выявлено большое солидное новообразование, с неоднородной структурой, с мелкими участками низкой плотности, с включениями кальция. Оно имело бугристые контуры, размеры 93х78х100 мм, деформировало наружный контур почки, выходя за ее контур. Новобразование вовлекало верхние отделы чашечно-лоханочной системы почки. Отмечалось распространение изменений на левый мочеточник протяженностью около 40 мм (рис. 2). При внутривенном введении контрастного препарата вышеописанное образование неравномерно его накапливало в артериальную и венозную фазы контрастирования. Имелись увеличенные региональные парааортальные лимфатические узлы размерами до 14х9 мм.
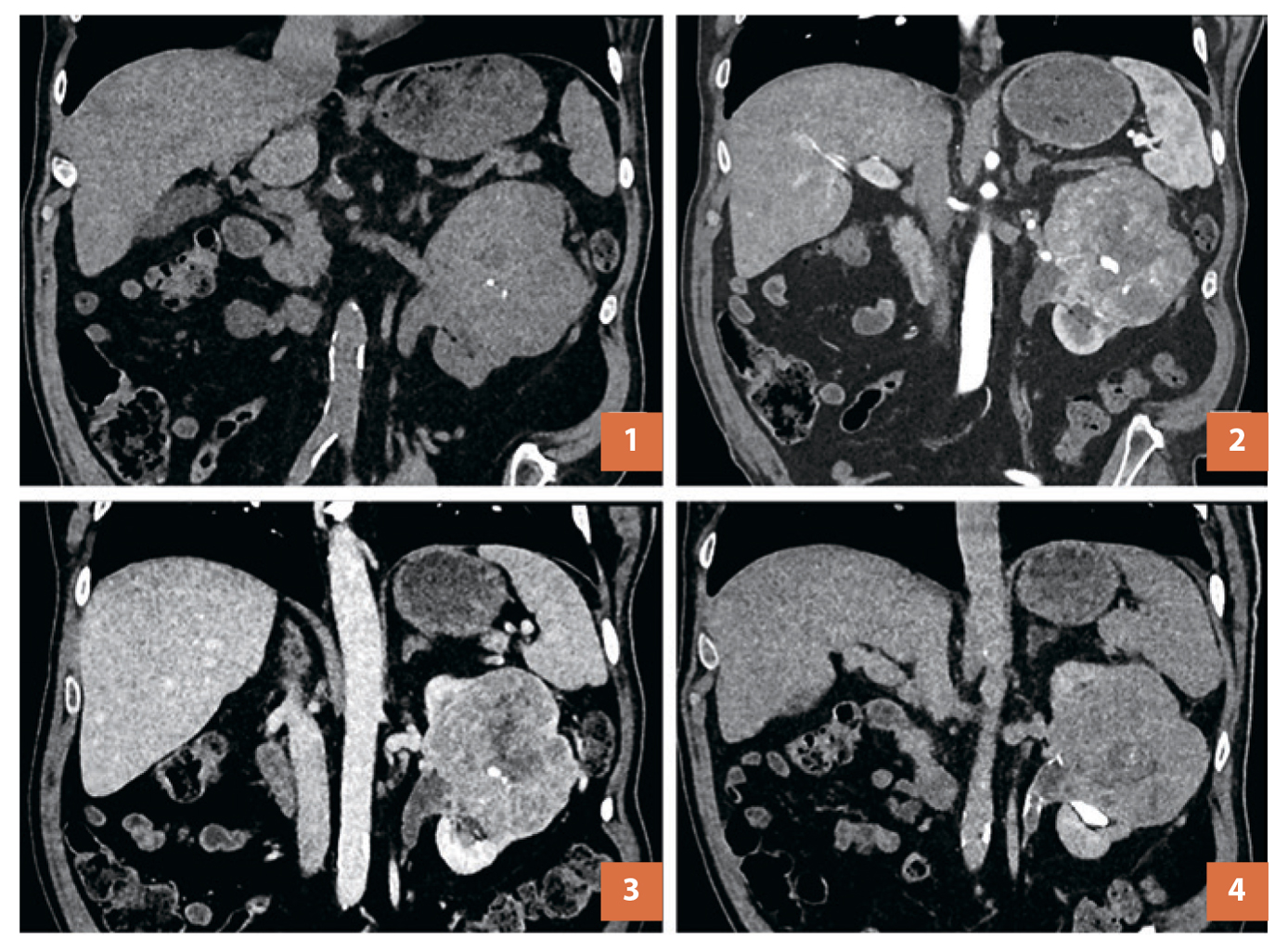
Рис. 2. КТ ОБП с внутривенным контрастированием, опухоль левой почки, коронарные реконструкции. (1) – нативная фаза, (2) – артериальная фаза, (3) – венозная фаза,
(4) – выделительная фаза.
В нативную фазу сканирования производится оценка плотности визуализруемого образования, по результатам которого определяется плотность его структуры в очагах с различной плотностью. Результаты измерения представлены в таблице. Кистозно-некротический компонент соответствовал плотности от 32 до 40 HU в различные фазы выполнения исследования без признаков накопления контрастного вещества. После контрастного усиления отмечалось накопление контрастного препарата именно солидным компонентом, максимум контрастирования достигается в артериальную фазу и соответствует значению 177 HU.
После выполнения стандартного КТ ОБП с внутривенным контрастированием производится анализ исследования, выполненного по настроенному протоколу с двухэнергетическим сканированием в венозную фазу. Полученные с помощью ДЭКТ изображения представлены на рис. 3.
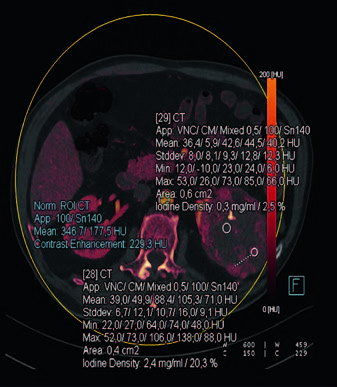
Оценка полученных результатов осуществляется на базе построенных карт распределения йода. Обработка по алгоритму Virtual Unenhanced, в основе которого лежит декомпозиция данных по трём материалам – воде, воздуху, йоду. Установив показатель разрешающей способности (resolution) – 2, мы получили информацию вычисления содержания йода в мг и процентах по двум объемным элементам (пикселям) изщображений. Значения пикселей в изображении отражают концентрацию атомов йода в мг. На полученных изображениях (рис. 4) с помощью определения концентрации йода в зоне интереса патологически измененной почки, оценивалась их васкуляризация.
На рис. 4 представлена йодная карта, полученная при оценке опухоли левой почки в аксиальной проекции. На данных изображениях также возможна оценка плотности образования на основании единиц Хаунсфилда (HU), однако наиболее информативным в точки зрения физических основ выполнения исследования является именно показатель накопления йода. Так, показатель концентрации йода 0,3 мг/мл/2,5% соответствует зоне некроза, в то время как близлежащий участок со значениями йодной плотности 2,4 мг/мл/20,3% – обильно васкуляризированной зоне, что в совокупности подтверждает злокачественную природу новообразования.
Для повышения точности анатомической оценки данных ДЭКТ, была выполнена мультипланарная реконструкция ДЭКТ (рис. 5).
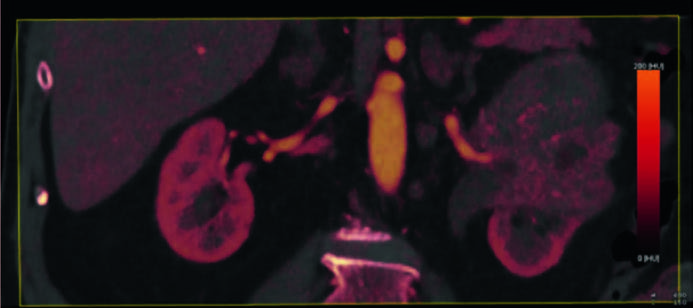
Показатели концентрации йода, соответствующие зоне некроза, составили 0,3 мг/мл / 2,8% и 0,5 мг/мл / 4,1% для фронтальной и сагиттальной проекциях соответственно. Прилежащие к ним зоны, соответствующие высоко васкуляризированным зонам, характеризовались более высокими показателями концентрации йода: 3,1 мг/мл / 26,1% и 2,9 мг/мл / 23,9% для фронтальной и сагиттальной проекций соответственно. По выявленной совокупности КТ-признаков был установлен диагноз: Опухоль левой почки сT2bN0M0 С64.
Онкоконсилиумом МНОЦ было принято решение о выполнении лапароскопической нефруретерэктомии слева. В ходе подготовки к операции пациент уложен в положение на правом боку, выполнена обработка операционного поля. Установлены четыре троакара в типичных местах (10 мм, 5 мм, 5 мм, 5 мм). При ревизии органов брюшной полости грубых патологических изменений и метастатического поражения не выявлено. По линии Тольда брюшина вскрыта, кишка мобилизована, смещена медиально. Выделены левая почечная вена и почечная артерия, надпочечниковые сосуды (две почечные артерии, одна почечная вена). Тупым и острым методом с применением Ligasure выделена левая почка с надпочечником. На почечную артерию и вену наложены 2 клипсы, затем пересечены. Надпочечниковые артерии и вены пересечены с использованием аппарата Ligasure. Мочеточник выделен максимально низко к мочевому пузырю, клипирован. Выполнена нефрадреналэктомия слева. Выполнена парааортальная лимфаденэктомия. Гемостаз. Почка с надпочечником, парааортальными лимфоузлами удалены единым блоком в контейнере через расширенный троакарный доступ. Троакары удалены. Швы на рану. Суммарная кровопотеря 500 мл. Учитывая постгеморрагическую анемию пациенту выполнено переливание двух доз эритроцитарной массы.
На 6-е сутки после операции пациент был выписан в удовлетворительном состоянии. По результатам прижизненного патологоанатомического исследования операционного материала был получено заключение – светлоклеточный почечноклеточный рак G2, с очагами некроза и кровоизлияния.
За 2 года последующего наблюдения за пациентом (в течение которых выполнялись УЗИ и КТ) отдалённых осложнений оперативного вмешательства или рецидива не наблюдалось.
Обсуждение
Настоящее клиническое наблюдение показывает возможность применения ДЭКТ для оценки зон повышенной васкуляризации и некроза в структуре единого новообразования почки. Строго говоря, диагноз опухоли почки был очевиден и по данным обычной КТ и, с учетом ее данных, имелись абсолютные показания к выполнению нефруретероэктомии. Однако это наблюдение демонстрирует возможности ДЭКТ добавлять количественную информацию о полимеризации различных частей и компонентов опухоли к данным стандартной КТ. Очевидно, что применение ДЭКТ расширяет возможности КТ в дифференциальной диагностике и количественном анализе новообразований почек. Одним из основных диагностических критериев является установление наличия или отсутствия васкуляризации ткани новообразования, что может быть визуализировано и проанализировано при помощи йодных карт, получаемых при двухэнергетическом режиме. Таким образом, ДЭКТ позволяет различать сосудистые и несосудистые элементы в структуре новообразования почки [8].
Светлоклеточный рак составляет 70–75% всех случаев почечно-клеточного рака [9]. Опухоль преимущественно солитарная и расположена в корковом веществе почки. Мультицентричные и/или билатеральные поражения при спорадическом раке составляют менее 5% [10]. Большинство светлоклеточных раков на КТ-изображениях с внутривенным контрастированием имеет форму гиперваскулярных негомогенных узлов с четкими границами, формированием псевдокапсулы, а также наличием кист, очагов некроза, кровоизлияний, кальцинатов, жирового компонента. Помимо этого, в структуре новообразования выявляют солидный компонент, псевдососочковые структуры, участки саркоматоидной или рабдоидной дифференцировки [11].
По сравнению с обычной КТ, ДЭКТ дает возможность извлечь больше информации, относительно состава опухолевой ткани, используя методы декомпозиции тканей. Относительное количество конкретного вещества может быть определено для конкретных мелких объемных элементов (вокселей) изображений, включая воду, жир и йод [12].
Основываясь на селективном отображении йодсодержащих очагов, с помощью йодных карт (карт плотности йода на основе ДЭКТ), можно выявлять мелкие контрастирующиеся компоненты опухоли размером всего лишь в несколько миллиметров в пределах новообразования почки, проявляющиеся в виде пикселей с усиленным сигналом [13]. Таким образом можно получить более контрастное отображение (черно-белое или с цветовой кодировкой) с выбранной степенью отображения накопления йода, которая по умолчанию составляет 50% (то есть 50% йодсодержащих вокселей с цветной кодировкой накладывается на изображение мягких тканей в оттенках серого), но существует возможность его масштабирования до 100%. Было показано, что качественная оценка йодной карты, может обеспечить более быструю и уверенную интерпретацию изображений у пациентов с множественными новообразованиями почек по сравнению с традиционным методом, основанным на изменении затухания [14].
Предыдущие исследования показали, что концентрация йода в светлоклеточном почечноклеточном раке выше, чем в папиллярном почечноклеточном раке, однако исследования, сравнивающие значения концентрации йода в светлоклеточном и папиллярном раке с другими, менее распространенными опухолями почек, ограничены [11]. Метод количественного определения йода может помочь отличить более агрессивный фенотип светлых клеток рака от менее агрессивных типов. Возможность точной идентификации светлоклеточного почечноклеточного рака от других подтипов была воспроизведена в нескольких исследованиях с использованием различных платформ ДЭКТ и различных значений концентрации йода (диапазон: 0,9–3,1 мг/мл) [15]. Тем не менее, в отличие от задачи по характеристике новообразования почки, которая обычно представляет собой бинарную оценку (то есть «имеется контрастное усиление или его нет») почти исключительно зависящую от обнаружения йода (то есть наличие йода по сравнению с отсутствием йода). Для более точного диагноза опухоли почки на основе КТ-изображений может потребоваться идентификация более уникальных сигнатур или маркеров, характерных для фенотипической экспрессии опухоли. Комбинация данных ДЭКТ с неоднородностью опухоли и радиомикой дает надежду на дифференциацию подтипов опухоли, как показали более поздние исследования [16].
Заключение
Таким образом, ДЭКТ позволяет с большей точностью судить о природе новообразований почечной ткани по сравнению со стандартной КТ с внутривенным контрастированием. Возможности ДЭКТ расширяются в связи с возможностью селективного отображения йодсодержащих вокселей с помощью йодных карт, что позволяет проводить дифференциальную диагностику между участками некроза и высоковаскуляризованными участками в структуре мягкотканных компонентов. В связи с этим выполнение КТ с внутривенным контрастированием, а также сканирование в режиме ДЭКТ являются клинически оправданными алгоритмами диагностики, так как взаимодополняют друг друга и предоставляют ценную информацию для определения состояния пациента и дальнейшей тактики лечения.
Список литературы
-
Всемирная организация здравоохранения. https://www.who.int/ru.
- Cancer Taday. https://gco.iarc.fr/today/home.
- Матвеев В.Б., Маркова А.С. Рак почки: что нового в 2018 году. Онкоурология. 2018;4(12):48–52.
- Ховари Л.Ф., Шаназаров Н.А. Диагностика рака почки: современные тенденции. Фундаментальные исследования. 2011;(7):256–61.
- Graser A., Becker C.R., Staehler M., Clevert D.A., Macari M., Arndt N., Nikolaou K., Sommer W., Stief C., Reiser M.F., Johnson T.R.C. Single-phase dual-energy CT allows for characterization of renal masses as benign or malignant. Investigative radiology. 2010;45(7):399–405.
- Genant H.K., Boyd D. Quantitative bone mineral analysis using dual energy computed tomography. Investigative radiology. 1977;12(6):545–51.
- Raymakers J.A., Hoekstra O., van Putten J., Kerkhoff H., Duursma S.A. Fracture prevalence and bone mineral mass in osteoporosis measured with computed tomography and dual energy photon absorptiometry. Skeletal radiology. 1986;15(3):191–97.
- Boll D.T., Patil N.A., Paulson E.K., Merkle E.M., Nelson R.C., Schindera S.T., Roessl E., Martens G., Proksa R., Fleiter T.R., Schlomka J-P. Focal cystic high-attenuation lesions: characterization in renal phantom by using photon-counting spectral CT--improved differentiation of lesion composition. Radiology. 2010 Jan; 254(1):270–76.
- Пасечник Д.Г. Современные представления о гистологической классификации рака почки. Архив патологии. 2001;(6):50–55.
- Jacobs SC, Berg SI, Lawson RK. Synchronous bilateral renal cell carcinoma: total surgical excision. Cancer. 1980 Dec;46(11):2341–45.
- Cha D., Kim C.K., Park J.J., Park B.K. Evaluation of hyperdense renal lesions incidentally detected on single-phase post-contrast CT using dual-energy CT. The British journal of radiology. 2016 Jun;89(1062):20150860.
- Silva A.C., Morse B.G., Hara A.K., Paden R.G., Hongo N., Pavlicek W. Dual-energy (spectral) CT: applications in abdominal imaging. Radiographics?: a review publication of the Radiological Society of North America, Inc. 2011;31(4):1031–50.
- Morgan D..E. Dual-energy CT of the abdomen. Abdominal imaging. 2014;39(1):108–34.
- Danad I., Fayad Z.A., Willemink M.J., Min J.K. New Applications of Cardiac Computed Tomography: Dual-Energy, Spectral, and Molecular CT Imaging. JACC Cardiovascular imaging. 2015;8(6):710–23.
- Godoy, Naidich D.P., Marchiori E., Assadourian B, Leidecker C, Schmidt B, Vlahos I. Basic principles and postprocessing techniques of dual-energy CT: illustrated by selected congenital abnormalities of the thorax. Journal of thoracic imaging. 2009;24(2):152–59.
- Wang R., Yu W., Wang Y., He Y., Yang L., Bi T., Jiao J., Wang Q., Chi L., Yu Y., Zhang Z. Incremental value of dual-energy CT to coronary CT angiography for the detection of significant coronary stenosis: comparison with quantitative coronary angiography and single photon emission computed tomography. The international journal of cardiovascular imaging. 2011;27(5):647–56.









Комментарии