Протощак В.В., Сиваков А.А., Карандашов В.К., Синельников Л.М., Гозалишвили С.М., Чирский В.С., Ерохина А.А.
Сведения об авторах:
- Протощак В.В. – д.м.н., профессор, главный уролог Министерства обороны РФ, начальник кафедры и клиники урологии ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова» МО РФ; Санкт-Петербург, Россия; РИНЦ AuthorID 608157
- Сиваков А.А. – к.м.н., заместитель начальника кафедры и клиники урологии ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова» МО РФ; Санкт-Петербург, Россия; РИНЦ AuthorID 434496
- Карандашов В.К. – заведующий онкологическим отделением клиники урологии ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова» МО РФ; Санкт-Петербург, Россия;
- Синельников Л.М. – к.м.н. заведующий урологическим отделением клиники урологии ФГБОУ ВО «Военно-медицинская академия имени С.М. Кирова» МО РФ; Санкт-Петербург, Россия;РИНЦ AuthorID 581520
- Гозалишвили С.М. – врач-онколог онкологического отделения клиники урологии ФГБВОУ ВО «Военно-медицинская академия имени С.М. Кирова» МО РФ; Санкт-Петербург, Россия;РИНЦ AuthorID 971805
- Чирский В.С. – д.м.н., профессор, главный патологоанатом МО РФ, начальник центральной патологоанатомической лаборатории МО РФ; Санкт-Петербург, Россия; РИНЦ AuthorID 474448
- Ерохина А.А. – врач-патологоанатом центральной патологоанатомической лаборатории МО РФ; Санкт-Петербург, Россия; РИНЦ AuthorID 1015308
ВВЕДЕНИЕ
Рак мочевого пузыря (РМП) является серьезной медицинской и социальной проблемой, его лечение сопряжено с выполнением больших по объему органоуносящих хирургических вмешательств. Заболеваемость РМП в РФ неуклонно растет с 53,8 случаев на 100 000 населения в 2009 г. до 79,9 – в 2019 г. Выявляемость РМП на I и II стадиях выросла с 61,3% (от всех случаев) в 2009 г. до 78% в 2019 г. Количество «запущенных» случаев снизилось с 34,7% в 2009 г. до 20,1% – в 2019 г. [1, 2].
Рецидив РМП в уретре (уретральный рецидив) после перенесенной радикальной цистэктомии встречается достаточно редко. По данным современной литературы его частота составляет около 8% случаев: у женщин – 2-4%, у мужчин – 2-8% [3]. Наибольшее количество рецидивов РМП в уретру возникает в первые 24 месяца после радикальной цистэктомии, при этом медиана времени до их развития в больших сериях наблюдений колеблется от 8 до 28 месяцев [4-6].
Факторы риска развития рецидива РМП в мочеиспускательном канале, зависят от типа замещения мочевого пузыря, вовлечения простатического отдела уретры у мужчин, мультифокальности опухоли, поражения шейки мочевого пузыря и инвазии передней стенки влагалища у женщин, типа дифференцировки опухоли [7, 9].
Частота развития уретрального рецидива РМП при накожном отведении мочи несколько выше, чем при ортотопической реконструкции мочевого пузыря. Так, по сообщениям некоторых авторов, частота уретрального рецидива при формировании кондуита колеблется от 5,6% до 8%, в то время, как после выполнения ортотопической цистопластики их частота составляет 2,1%–4% [8, 9]. В настоящее время нет четкого обоснования различной встречаемости рецидива РМП в уретру после разных способов отведения мочи, однако некоторые авторы акцентируют внимание на том, что для ортотопической цистопластики осуществляется более тщательный предоперационный отбор пациентов с наименее агрессивными характеристиками опухолей [10].
С целью уменьшения количества рецидивов после радикальной цистэктомии ряд урологов применяет срочное гистологическое исследование хирургических краев по методике «frozen section» – патоморфологическое исследование замороженных краев резекции [11].
Необходимость наблюдения за состоянием мочеиспускательного канала после радикальной цистэктомии в настоящее время является дискутабельной. Уретральный рецидив РМП клинически может проявляться в виде кровотечения, выделений различного характера (встречается в 80% случаев) и болью в 32% наблюдений [12].
Цитологическое исследование отделяемого из мочеиспускательного канала (или промывных вод) – наиболее предпочтительный метод первичной диагностики уретрального рецидива РМП. Однако некоторые авторы выступают против его рутинного применения, так как оно не повышает выявляемость заболевания [13].
Лучевые методы исследования обладают высокой информативностью и чувствительностью в выявлении уретрального рецидива РМП. В диагностике уретрального рецидива РМП наиболее предпочтительно применение магнитно-резонансной томографии (МРТ) с парамагнитным усилением [14].
В настоящее время нет стандартного подхода к лечению уретрального рецидива РМП. Очевидно, что для пациентов с накожной деривацией мочи предпочтительным лечением является уретрэктомия, включающая удаление ладьевидной ямки у мужчин. У больных, перенесших ортотопическую цистопластику, применяется трансуретральное удаление рецидивных опухолей, инстилляции раствора 5-фторурацила, вакцины БЦЖ, а в случае неэффективности проводимой терапии – уретрэктомия и переход на накожную деривацию мочи [14, 15].
Учитывая небольшую статистику уретральных рецидивов РМП, описанных в отечественной и зарубежной литературе, данные о выживаемости этой группы пациентов отличаются. Медиана общей выживаемости колеблется от 6 до 54 месяцев, а 5-летняя специфическая выживаемость после выявления уретрального рецидива РМП по разным сообщениям варьирует от 0 до 83%. В одном из самых крупных исследований, посвященных уретральному рецидиву РМП, авторы заявляют, что двух-, трех- и пятилетняя специфическая выживаемость составила 85%, 65% и 55%, соответственно [15-17].
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Пациент Ч., 63 года, наблюдается в клинике урологии Военно-медицинской академии им. С.М. Кирова (ВМедА) с апреля 2019 г., обратившись с жалобами на белесоватые выделения из мочеиспускательного канала.
Из анамнеза известно, что с 2014 г. находится под наблюдением гематолога по поводу В-клеточного хронического лимфолейкоза I (Rai) A (Binet).
С сентября 2017 г. стал отмечать отхождение сгустков крови при мочеиспускании. По данным МРТ малого таза диагностирована опухоль на левой боковой стенке мочевого пузыря с инвазией мышечного слоя размерами до 4 см.
В октябре того же года в городском многопрофильном стационаре выполнена трансуретральная резекция (ТУР) мочевого пузыря. По данным гистологического исследования выявлена низкодифференцированная уротелиальная карцинома, high grаde (G3). Перед выполнением радикальной операции пациенту проведен курс химиотерапии (ХТ) по схеме GP (гемцитабин 1250 мг/м2+Цисплатин 100 мг/м2).
В марте 2018 г. в федеральном онкологическом стационаре выполнена лапароскопическая радикальная цистэктомия с формированием илеокондуита по Брикеру. Гистологическое заключение: папиллярная уротелиальная карцинома high grade (G3), распространяющаяся на простатический отдел уретры и периуретральные железы, В-клеточная лимфома из малых лимфоцитов с поражением тазовых лимфоузлов, инфильтрацией всех слоев стенки мочевого пузыря и перивезикальной жировой клетчатки; в предстательной железе: ацинарная аденокарцинома предстательной железы, сумма баллов по Глисону 6 (3+3).
В январе 2019 г. стал отмечать появление белесоватых выделений из мочеиспускательного канала. В клинике урологии Военно-медицинской академии в мае 2019 г. выполнена уретроскопия, по данным которой выявлены мелковорсинчатые образования. Произведена трансуретральная резекция новообразований мочеиспускательного канала. При морфологическом исследовании послеоперационного материала выявлена папиллярная неинвазивная карцинома. Учитывая впервые возникший рецидив, неинвазивный характер роста опухоли, а также малый объем поражения мочеиспускательного канала, было принято решении воздержаться от выполнения уретрэктомии и продолжить дальнейшее активное наблюдение за пациентом.
Через год выделения из мочеиспускательного канала появились вновь, в сентябре 2020 г. проведено обследование: восходящая уретрография, МРТ наружных половых органов и органов малого таза, уретроскопия (рис. 1). Уровень простатического специфического антигена на момент обследования был 0,13 нг/мл. Выполнена биопсия рецидивных новообразований уретры. По результатам гистологического исследования диагностирован инвазивный низкодифференцированный (GЗ) уротелиальный (переходно-клеточный) рак. Учитывая неэффективность выполненного ранее хирургического лечения и рецидивирующее течение заболевания, было принято решение о выполнении уретрэктомии.
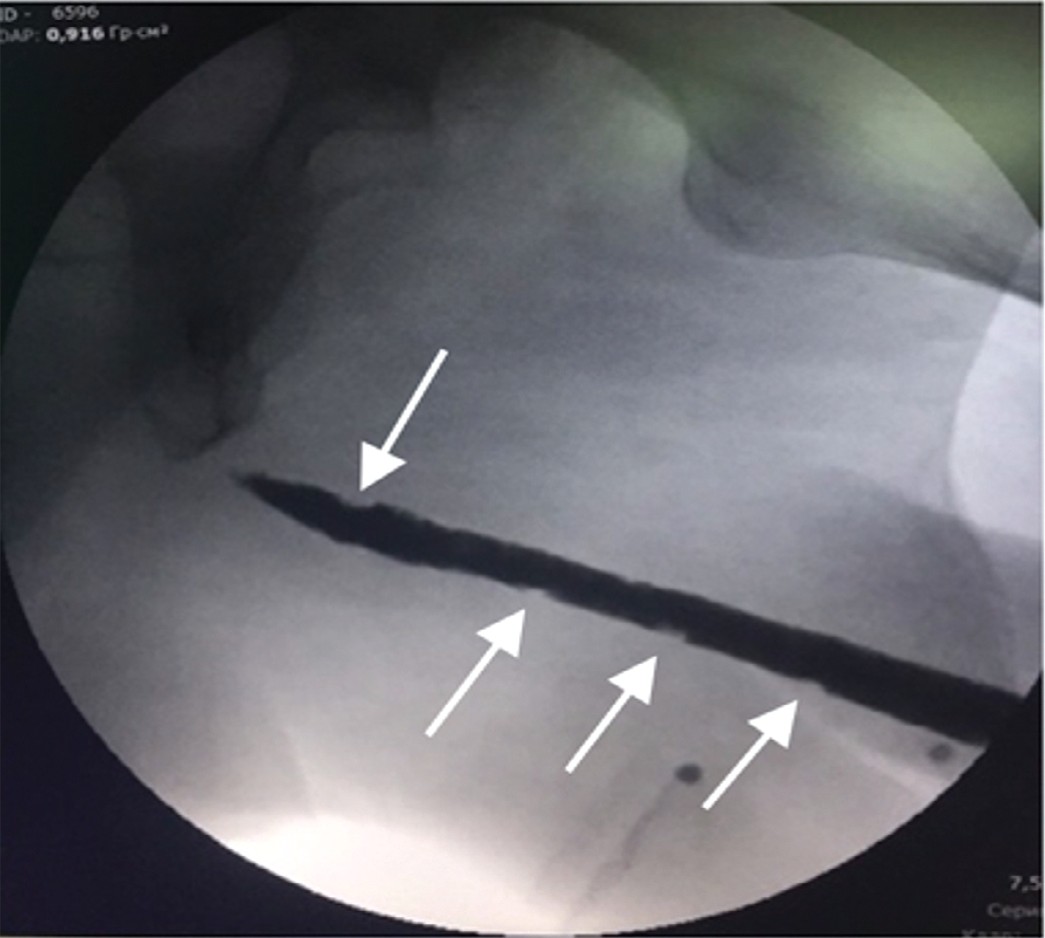
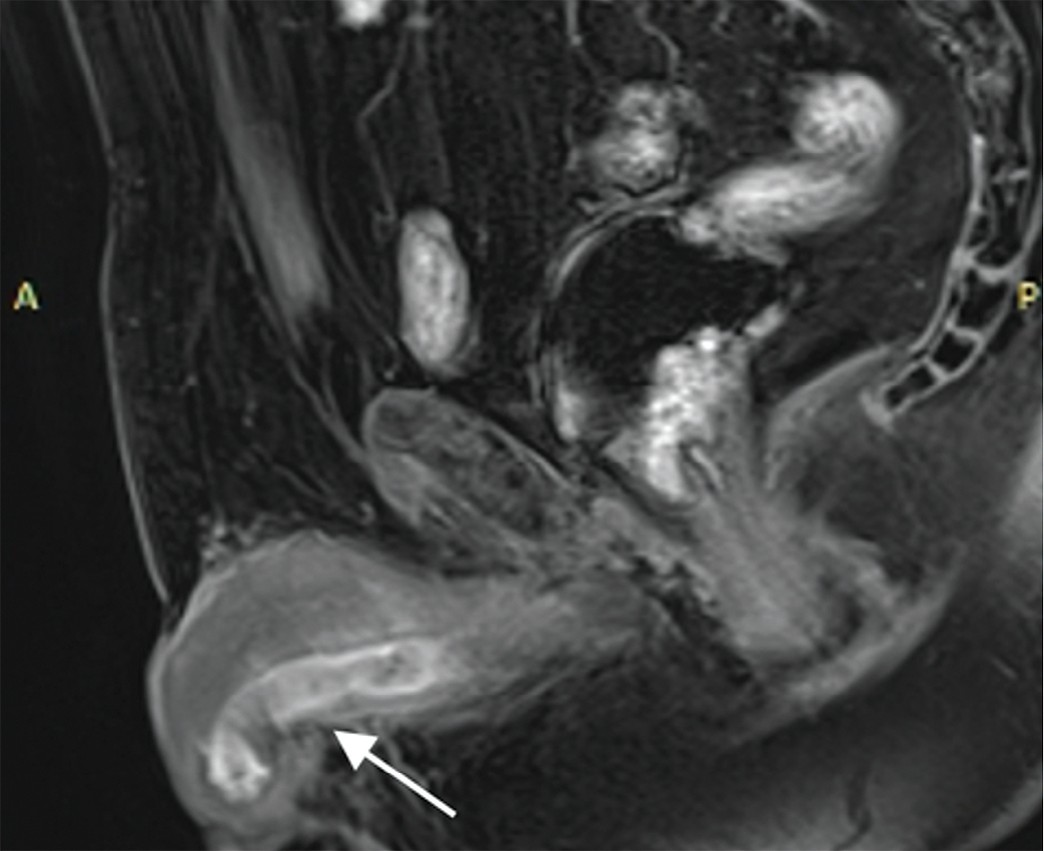
Рис. 1. а – уретрография: по ходу мочеиспускательного канала определяются множественные дефекты наполнения его просвета (указаны стрелками), соответствующие ворсинчатым новообразованиям; b – МРТ: расширение бульбозного отдела уретры, заполненное неоднородным содержимым, на фоне которого визуализируются солидные образования с нечеткими и неровными контурами, интенсивно накапливающее контрастный препарат; c – уретроскопия: в просвете мочеиспускательного канала определяются множественные ворсинчатые новообразования.
Fig. 1. а – urethrography: multiple defects of filling (villous neoplasms) are determined in the lumen of urethra (indicated by arrows); b – MRI: expanded bulbous urethra is filled with heterogeneous solid masses with indistinct and uneven contours intensively accumulating a contrast agent; c – urethroscopy: multiple villous neoplasms in the urethra.
В литотомическом положении, под общей анестезией осуществлен продольный промежностный доступ к уретре длиной 10 см. Осуществлен послойный доступ до бульбокавернозной мышцы, края раны разведены ретрактором Скотта. По срединной линии рассечены волокна бульбокавернозной и поверхностной поперечной мышц промежности.
Половой член выведен в рану промежности с применением метода «снятой перчатки». Уретра мобилизована в дистальном и проксимальном направлениях. Клиновидным разрезом иссечена дистальная часть уретры вместе с ладьевидной ямкой. В мембранозном отделе уретра отсечена. Уретра удалена с бульбокавернозными мышцами. Рана послойно ушита с оставлением дренажа по Редону (рис. 2-4).
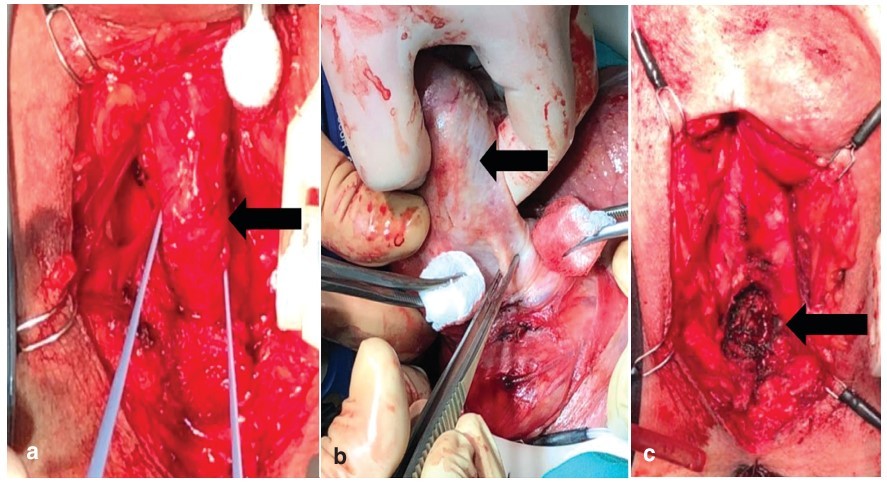
Рис. 2. Этап уретрэктомии. а – уретра взята на «держалку» (стрелкой указано губчатое тело с мочеиспускательным каналом); b – применение метода «снятой перчатки» для выведения полового члена в промежностную рану (стрелкой указан половой член «вывернутый» в рану); c – вид операционной раны после удаления мочеиспускательного канала (стрелкой указано ложе удаленной уретры)
Fig. 2. Stage of urethrectomy. a – the urethra is taken on a "holder" (the arrow indicates the spongy body with the urethra); b – the use of the "removed glove" method to remove the penis into the perineal wound (the arrow indicates the penis "turned out" into the wound); c – the type of surgical wound after removal of the urethra (the arrow indicates the bed of the removed urethra)
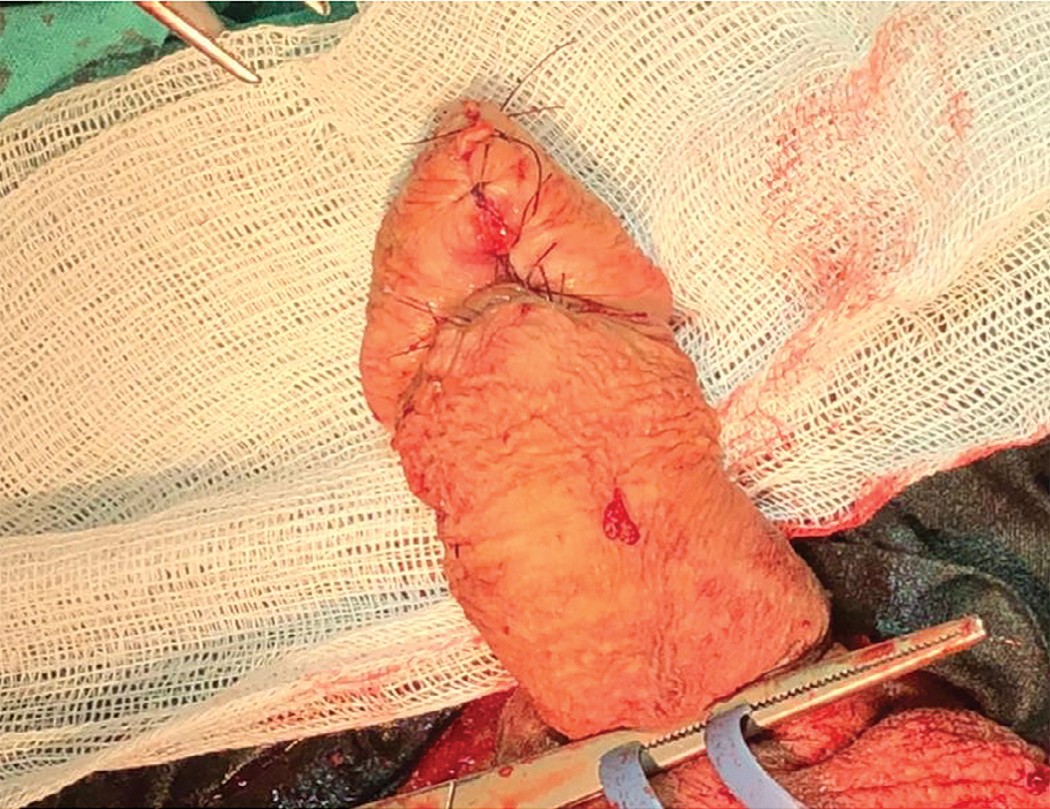
Рис 3. Вид послеоперационной раны после удаления уретры
Fig. 3. The postoperative wound after removal of the urethra
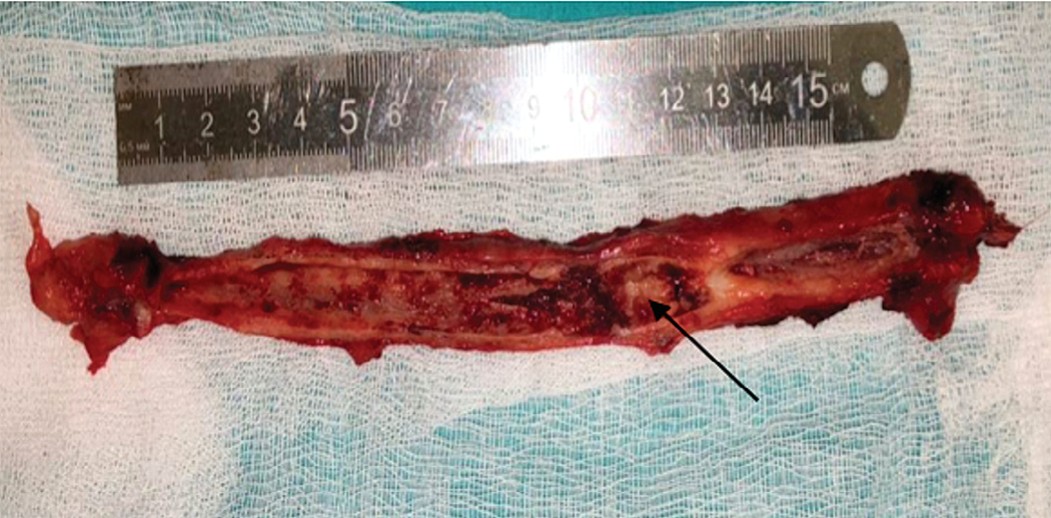
Рис. 4. Макропрепарат: удаленная уретра (в разрезе), стрелкой указана одна из ворсинчатых опухолей
Fig. 4. Removed urethra (has been cutted along), the arrow indicates one of the villous tumors
Ранний послеоперационный период протекал без особенностей. Швы сняты на 7-е сутки, пациент выписан в удовлетворительном состоянии на 8-е сутки. По данным гистологического исследования выявлен низкодифференцированный уротелиальный (переходноклеточный) рак высокой степени злокачественности с признаками внутрисосудистой инвазии спонгиозного тела (рис. 5).
Установлен диагноз: Первично-множественный метахронный рак:
- В-клеточный хронический лимфолейкоз I (Rai) A (Binnet) стадии. Стабилизация.
- РМП pT2N0M0G3C4 II стадии. Комбинированное лечение: ТУР мочевого пузыря, три цикла ХТ по схеме GP. Радикальная лапароскопическая цистэктомия с формированием илеокондуита по Брикеру. Прогрессирование опухолевого процесса: уретральный рецидив. Трансуретральная резекция новообразования мочеиспускательного канала. Уретральный рецидив.
- Рак предстательной железы pT1aN0M0G1C4 I стадии.
Последующий контроль с целью исключения рецидива заболевания будет включать в себя МРТ малого таза и наружных половых органов, а также компьютерную томографию органов брюшной полости и наблюдение онкогематологом.
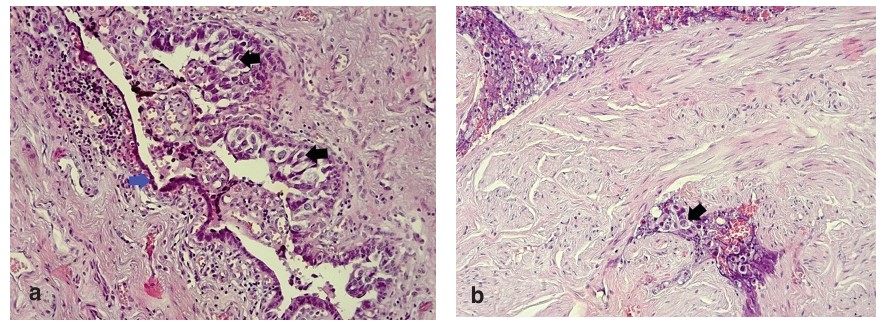
Рис. 5. Микропрепарат. а – поперечный срез уретры, эпителиальная выстилка представлена цилиндрическим эпителием (синяя стрелка), уротелиальная неоплазия высокой степени (черные стрелки); увеличение х200, окраска гематоксилином и эозином. b – corpus spongiosum с наличием опухолевых структур в синусах (указаны стрелкой); увеличение х200, окраска гематоксилином и эозином.
Fig. 5. Hystology: a – cross-section of the urethra, the epithelial lining is represented by a cylindrical epithelium (blue arrow), high-grade urothelial neoplasia (black arrows); x200 increase, staining with hematoxylin and eosin. b – corpus spongiosum with the presence of tumor structures in the sinuses (indicated by an arrow); x200 magnification, staining with hematoxylin and eosin.
ЗАКЛЮЧЕНИЕ
Частота уретрального рецидива РМП после радикальной операции варьирует от 2 до 8%. Факторами, способствующими его развитию, является вовлечение простатического отдела уретры, опухолевое поражение передней стенки влагалища, поражение шейки мочевого пузыря, а также мультифокальность опухоли и низкая степень ее дифференцировки.
У представленного пациента помимо общих причин развития рецидива присутствовали дополнительные факторы в виде хронического онкогематологического заболевания и рака предстательной железы. Они, в свою очередь, могли способствовать снижению общей антибластомной резистентности организма и повысить вероятность развития уретрального рецидива РМП.
Для ранней диагностики опухолевых изменений в уретре у пациентов, имеющих факторы риска развития рецидива РМП после цистэктомии, целесообразно тщательное наблюдение в виде цитологического исследования промывных вод из нее, выполнение уретроскопии с восходящей уретрографией и МРТ наружных половых органов.
Данный клинический случай является показательным и еще раз подтверждает необходимость сохранения онкологической настороженности относительно местного рецидива РМП у пациентов, перенесших радикальную цистэктомию вне зависимости от выбора метода отведения мочи.
ЛИТЕРАТУРА
- Состояние онкологической помощи населению России в 2019 году. Под. ред. Каприна А.Д., Старинского В.В., Шахзадовой А.О.; М.: 2020; 239 с. [The state of cancer care in Russia in 2019. Kaprin A.D., Starinskii V.V., Shachzadova A.O. eds (In Russian); Moscow, 2020;239 p.].
- Протощак В.В. Внутрипузырная терапия рака мочевого пузыря: современное состояние проблемы. Онкоурология 2011;(3):136-143. [Protoschak V.V. Intravesical therapy of bladder cancer: the current state of the problem. Cancer Urology 2011(3):136-143. (In Russian)].
- Fahmy O, Khairul-Asri MG, Schubert T, Renninger M, Kübler H, Stenzl A, Gakis G. Urethral recurrence after radical cystectomy for urothelial carcinoma: a systematic review and meta-analysis. Urol Oncol 2018;36(2):54-59. https://doi.org/10.1016/j.urolonc.2017.11.007.
- Taylor JM, Spiess PE, Kassouf W, Munsell MF, Kamat AM, Dinney CPN, et al. Management of urethral recurrence after orthotopic urinary diversion. BJU Int 2010;106(1):56-61. https://doi.org/10.1111/j.1464-410X.2009.09095.x.
- Huguet J. Diagnosis and treatment of urethral recurrence after radical cystectomy in the male. Actas Urol Esp 2012;36(1):42-7. https:// doi.org/ 10.1016/j.acuro.2011.06.009.
- Sherwood JB, Sagalowsky AI. The diagnosis and treatment of urethral recurrence after radical cystectomy. Urol Oncol 2006;24(4):356-361. https://doi.org/10.1016/j.urolonc.2005.11.027.
- Hrbacek J, Macek P, Ali-El-Dein B, Thalmann GN, Stenzl A, Babjuk M, et al. Treatment and outcomes of urethral recurrence of urinary bladder cancer in women after radical cystectomy and orthotopic neobladder: a series of 12 cases. Urol Int 2015;94(1):45-9. https://doi.org/10.1159/000363112.
- Mitra AP, Alemozaffar M, Harris BN, Schuckman AK, Skinner EC, Daneshmand S. Outcomes after urothelial recurrence in bladder cancer patients undergoing radical cystectomy. Urology 2014;84(6):1420-6. https://doi.org/10.1016/j.urology.2014.05.080.
- Huguet J, Monllau V, Sabaté S, Rodriguez-Faba O, Algaba F, Palou J, Villavicencio H. Diagnosis, risk factors, and outcome of urethral recurrences following radical cystectomy for bladder cancer in 729 male patients. Eur Urol 2008;53(4):785-92. https://doi.org/10.1016/j.eururo.2007.06.045.
- Stein JP, Clark P, Miranda G, Cai J, Groshen S, Skinner DG. Urethral tumor recurrence following cystectomy and urinary diversion: clinical and pathological characteristics in 768 male patients. J Urol 2005;173(4):1163-8. https://doi.org/10.1097/01.ju.0000149679.56884.0f.
- Satkunasivam R, Hu B, Metcalfe C, Ghodoussipour SB, Aron M, Cai J, et al. Utility and significance of ureteric frozen section analysis during radical cystectomy. BJU Int 2016;117(3):463–8. https://doi.org/10.1111/bju.13081.
- Moschini M, Karnes RJ, Sharma V, Gandaglia G, Fossati N, Dell'Oglio P, et al. Patterns and prognostic significance of clinical recurrences after radical cystectomy for bladder cancer: a 20-year single center experience. Eur J Surg Oncol 2016;42(5):735-743. https://doi.org /10.1016/j.ejso.2016.02.011.
- Boorjian SA, Kim SP, Weight CJ , Cheville JC, Thapa P, Frank I. Risk factors and outcomes of urethral recurrence following radical cystectomy. Eur Urol 2011;60(6):1266-72. https://doi.org/10.1016/j.eururo.2011.08.030.
- Giannarini G, Kessler TM, Thoeny HC, Nguyen DP, Meissner C, Studer UE. Do patients benefit from routine follow-up to detect recurrences after radical cystectomy and ileal orthotopic bladder substitution? Eur Urol 2010;58(4):486-494. https://doi.org/10.1016/j.eururo.2010.05.041.
- Xiaozhou Z, Ji H , Zhang H, Xiong T, Pan J , Chen Z. Treatment and outcomes of urethral recurrence after orthotopic neobladder replacement in patients with bladder cancer — practice in a single centre. J Int Med Res 2018;46(9)(10):3928-37. https://doi.org/10.1177/0300060518782015.
- Huguet J, Jorge Huguet 1, Palou J, Serrallach M, Solé Balcells FJ, Salvador J, Villavicencio H. Management of urethral recurrence in patients with Studer ileal neobladder. Eur Urol 2003;43(5):495-8. https://doi.org/10.1016/s0302-2838(03)00096-4.
- Clark PE, Stein JP, Groshen SG, Miranda G, Cai J, Lieskovsky G, Skinner DG The management of urethral transitional cell carcinoma after radical cystectomy for invasive bladder cancer. J Urol 2004;172(4Pt1):1342-7. https://doi.org/10.1097/01.ju.0000138208.07426.19.









Комментарии