С.В. Москвин1 , С.Ю. Боровец2 , В.А. Торопов2
1 ФГБУ «Государственный научный центр лазерной медицины ФМБА России», Москва;
2 ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России
Введение
Мужское бесплодие представляет собой многофакторный синдром, включающий широкий спектр нарушений, симптом множества различных патологических состояний, затрагивающих как половую, так и другие системы организма: эндокринную, нервную, кровеносную, иммунную (табл. 1) [1–3].
Таблица 1. Причины снижения мужской репродуктивной функции [1–3, 5–7]
|
Нарушения эякуляции |
|
|
|
| Приобретенные |
|
| Анатомические |
|
| Аномалии развития и строения |
|
| Нарушения качества спермы |
|
| Гормональные причины и нечувствительность к андрогенам |
|
| Идиопатические причины |
|
Согласно рекомендациям ВОЗ (2000) выделяют 16 основных нозологий [4], каждая из которых, в свою очередь, включает до нескольких десятков конкретных патогенетических факторов, 4 из 16 диагнозов являются описательными, без указания на истинную причину: идиопатическая олиго-, астено-, тератои азооспермия. Причины снижения мужской репродуктивной функции представлены в таблице 1.
Сексуально активная пара, не предохраняющаяся в течение года и не имеющая детей, по данным ВОЗ, расценивается как бесплодная. В течение первого года около 25 % супружеских пар не достигают беременности. Из них 15 % обращаются за медицинской помощью, а менее 5 % так и не добиваются успеха. В половине случаев бесплодие пары обусловлено нарушением фертильности мужчины. Причинами мужского бесплодия могут быть врожденные и приобретенные аномалии половых органов, инфекции мочеполовой системы, повышение температуры мошонки (варикоцеле), эндокринные нарушения, генетические аномалии и иммунологические факторы [8].
Высказывается мнение, что большая часть идиопатических форм генетически обусловлена мутациями и полиморфизмом многих генов [1]. Однако на самом деле это всего лишь гипотеза, не имеющая строгих доказательств и требующая детального изучения [9]. Безусловно, какие-то патологии связаны именно с мутацией, то есть повреждением ДНК, но нет сомнений в том, что в подавляющем большинстве случаев это лишь результат эпигенетических изменений генома, носящих обратимый характер [10]. В то же время известно, что низкоинтенсивный лазерный свет не только эффективно защищает клетки от повреждения ДНК различными физическими и химическими патогенными факторами, но и способен активировать «нужные» гены, что используется в селекции [11].
Наиболее вероятно, что такой разброс данных обусловлен различиями в способах оценки состояния пациентов, используемых методов диагностики, наличия или отсутствия той или иной аппаратуры. Безусловно, влияние оказывает и то, в какой стране проводились исследования. Однако вполне уверенно можно говорить о том, что ведущими факторами, которые оказывают наибольшее влияние на мужскую фертильность, являются последствия урогенитальных инфекций, в том числе вирусных [12–14], и связанные с этим нарушения иммунной системы, патологии яичек и предстательной железы (варикоцеле, эпидидимоорхит, простатит) [15–19], а также эндокринные нарушения [20, 21]. Хронический неспецифический простатит (ХНП), по разным данным, вызывает инфертильность в 52–76 % случаев [22–25]. При этом, несмотря на активные споры и обсуждения темы наличия/отсутствия «полноценной» диагностики, факт идиопатических нарушений качества спермы в более чем половине случаев мужского бесплодия не вызывает сомнений. Следовательно, именно неспецифические методы лечения, направленные на «общее оздоровление», запускающие механизмы саногенеза, восстановление нарушенного гомеостаза и нормального физиологического регулирования, в первую очередь должны рассматриваться клиницистами как базовые.
Диагностика мужского бесплодия основана на комплексной оценке состояния мужской репродуктивной системы, проводится в известной последовательности с применением анамнестического, клинического, лабораторных и специальных методов обследования. На сегодня существует большое разнообразие диагностических методов обследования [8], хотя в целом вопросы диагностики нуждаются в более глубокой и всесторонней проработке.
Наиважнейшей составляющей лечения является устранение потенциально вредных факторов окружающей среды, работы и образа жизни. При некоторых аномалиях, например крипторхизме, травмах, инфекциях, действии токсических веществ и лекарственных препаратов, бесплодие можно предотвратить. Для восстановления фертильности мужчин необходимо:
- наладить нормальный ритм труда и отдыха, полноценное питание, лечение сопутствующих заболеваний, ритм половой жизни;
- исключить перегревание, снизить физические нагрузки при занятиях экстремальными видами спорта;
- устранить факторы, вызывающие депрессию, состояние страха, неврозы.
Выполнение этих условий во многих случаях способствует улучшению показателей спермограммы [1, 2, 8], следовательно, в большинстве случаев причиной заболевания служат неспецифические нарушения физиологических процессов, влияющих на сперматогенез.
К сожалению, этиотропное и патогенетическое лечение, дающее хорошие результаты, в большинстве случаев неприменимо по причине невозможности однозначного установления специфической причины возникновения заболевания и недостаточности знаний в части механизмов развития болезни. В.А. Божедомов и др. (2013) [1], критикуя «эмпирическую», то есть неспецифическую, терапию за неэффективность (правда, не упоминая физиотерапию, в том числе лазерную, а также курортологию), указывают на необходимость проведения «третичной профилактики» с целью уменьшения осложнений после применения других методов лечения.
Обращает на себя внимание то обстоятельство, что практически ни в одном обзоре литературы и монографиях, посвященных мужскому бесплодию, нет упоминания о физиотерапевтических методах лечения. Тем не менее лазерная терапия, активно развивающаяся в последние годы, не только не имеет противопоказаний и побочных эффектов, но и обладает ярко выраженными протекторными свойствами [11] и, самое главное, демонстрирует высочайшую эффективность лечения во многих областях медицины, в том числе в акушерстве и гинекологии [26], андрологии и урологии [27–29], рекомендуется как составная часть комплексного решения проблемы бесплодия [16], то есть успешно применяется именно теми специалистами, которые так или иначе сталкиваются с проблемой бесплодия.
Во многих случаях бездетный брак — проблема именно семейной пары [16], но вполне очевидно, что для изучения вопросов взаимодействия сторон необходимо максимально подробно разобраться в соответствующих нарушениях, присущих каждому полу, а также обосновать возможность использования лазерной терапии. Поэтому в данной статье рассматривается только мужское бесплодие, но с перспективой изучения вопроса возможного влияния низкоинтенсивного лазерного излучения (НИЛИ) на женскую фертильность, в том числе в рамках решения некоторых вопросов, возникающих при экстракорпоральном оплодотворении (ЭКО).
Понимание биомодулирующих процессов, происходящих в результате поглощения НИЛИ и лежащих в основе методологии лазерной терапии (ЛТ), позволило обосновать многие методики, а также оптимизировать уже известные в разных областях медицины. Первичный механизм биомодулирующего действия НИЛИ заключается в ответной реакции организма на неспецифическое, то есть не связанное с конкретными акцепторами, поглощение лазерного света в различных клетках, в результате чего инициируется кратковременное повышение концентрации ионов кальция в цитозоле, распространение волн повышенной концентрации Ca2+ как в клетках, так и в различных биотканях. Затем развивается ответная реакция организма (вторичные механизмы), которая начинается с активации Ca2+-зависимых процессов [30, 31].
Экспериментальные исследования
Воздействовать лазерным лучом для изучения различных физиологических процессов, определяющих, в частности, подвижность сперматозоидов, начали чуть ли не с момента появления лазеров [32]. Многочисленные исследования подтверждают положительное влияние НИЛИ на сперматозоиды различных животных, увеличивается их подвижность и содержание аденозинтрифосфата (АТФ) [33–41], повышается продолжительность жизни клеток и вероятность оплодотворения. Именно повышение концентрации Ca2+, в том числе вызванное лазерным освечиванием, стимулирует работу митохондрий и синтез АТФ [31], что играет ключевую роль в обеспечении подвижности сперматозоидов. Указывается также на связь между Ca2+-зависимым высвобождением NO в освечиваемых сперматозоидах (оптимальная экспозиция — 5 мин) с повышением их активности, хотя, вероятнее всего, это лишь вторичный эффект.
Большинство экспериментов проводилось in vitro, но есть и исключения. В частности, M.D. Porras et al. (1986) показали увеличение числа сперматогониев и активацию сперматогенеза после воздействия непрерывным ИК НИЛИ на яички. Также сообщается о значительном увеличении производства тестостерона интерстициальными клетками яичек мышей (клеток Лейдига) вследствие лазерного освечивания красным непрерывным НИЛИ с длиной волны 633 нм [42, 43].
В одной из работ [44] лазерное освечивание непрерывным НИЛИ с длиной волны 830 нм в модулированном режиме (мощность — 30 мВт, частота — 300 Гц) осуществляли непосредственно на семенники крыс линии Вистар, продемонстрирован как стимулирующий, так и ингибирующий эффекты сперматогенеза в зависимости от плотности мощности и экспозиции лазерного света. Ошибки предшественников через много лет повторили с непонятной целью другие авторы, уже воздействуя с совершенно неприемлемыми параметрами на яички баранов и получив вполне ожидаемый отрицательный результат [45]. Из этих работ можно сделать два важных вывода: не нужно концентрировать лазерный луч в точку, а также светить более 1,5 мин. Также не трудно понять, что воздействие УФ-светом высокой интенсивности губительно для клеток. Поэтому к выбору параметров лазерного освечивания с целью активизации жизненных процессов требуется подходить с осторожностью и предварительно их обосновывать.
Исследования группы авторов указывают на прямую связь между повышением внутриклеточной концентрации Ca2+ и стимулированием оплодотворяющей способности сперматозоидов как животных, так и человека [39, 46]. Необходимо заметить, что в ряде работ делаются ошибочные выводы о ведущей роли активных форм кислорода (АФК) в стимулировании НИЛИ различных процессов [46], однако это совершенно не так. АФК — это лишь вторичные продукты активированного лазерным светом клеточного метаболизма [31], то есть следствие, а не причина.
Лазерная стимуляция является более эффективной и менее затратной технологией, которая может быть использована на достаточно хорошей научной основе для совершенствования искусственного осеменения и эффективности эмбриональных систем [33]. В результате лазерного освечивания in vitro повышается качество спермы быков, кроликов и птицы, используемой после длительного хранения в замороженном состоянии: увеличивается проникающая способность сперматозоидов (капацитация), индуцируется их акросомная реакция при снижении процента погибших клеток [38, 47–49].
Необходимо обратить внимание на исследование, в котором показано, что лазерное освечивание непрерывным НИЛИ красного спектра (633 нм, 10 мВт, площадь светового пятна — 0,125 см2 , экспозиция — 1–5 с) незрелых ооцитов коров in vitro негативно сказывается на процессе их созревания [50], хотя такого не наблюдалось в других аналогичных исследованиях. Возможно, все дело в параметрах методик освечивания и различиях в экспериментальных моделях, и этот вопрос еще нужно изучать. То, что воздействие лазерным светом с высокой энергетической плотностью может навредить, в том числе погубить зародыш, известно давно. Для обеспечения безопасной работы с лазерами необходимо руководствоваться соответствующими нормативными документы, данными многочисленных исследований и здравым смыслом, в конце концов.
Вероятно, имеет значение и тот известный факт, что обязательным условием оплодотворения является возникновение и прохождение по всему объему яйцеклетки десятков (до 50) волн повышенной концентрации ионов кальция, высвобождающегося исключительно из депо эндоплазматического ретикулума [51]. Механизмы реализации и физиологическая необходимость этого процесса неизвестны до сих пор, хотя активно изучаются много лет, но понятно одно, что НИЛИ реализует свои биомодулирующие свойства именно через активацию Ca2+-зависимых внутриклеточных реакций, воздействуя на те же самые депо кальция. Следовательно, лазерное освечивание потенциально может препятствовать оплодотворению. Возможно, такие специфические, характерные только для ооцитов процессы каким-то образом связаны с их созреванием или какими-то отдельными его этапами. Пока это неизвестно, будем придерживаться той точки зрения, что использовать любые технологии лазерного воздействия на ооциты и яйцеклетку преждевременно.
Данные исследований, проводимых для целей животноводства, могут быть применены и в медицине. Более того, есть вполне убедительные доказательства, что низкоинтенсивный, как лазерный, так и некогерентный, свет позволяет существенно повысить выживаемость, подвижность и скорость перемещения сперматозоидов человека [52–55].
Выбор оптимальной длины волны и режима работы лазера для различных способов воздействия
В большинстве исследований на животных освечивание проводилось практически только непрерывным НИЛИ в красном (633–650 нм), значительно реже в других спектральных диапазонах (табл. 2).
Таблица 2. Длины волн источников света в экспериментальных исследованиях по изучению свойств сперматозоидов
| Длина волны, нм | Ссылки |
| 532 | Abdel-Salam Z. et al., 2011 [34] |
| 633–637 | Гизингер О.А., Францева О.В., 2016 [52]; Cohen N. et al., 1998 [46]; Dreyer T.R. et al., 2011 [37]; Dobrin N. et al., 2015 [47]; Iaffaldano N. et al., 2013 [38]; Ocaña-Quero J.M. et al., 1995 [50], 1997 [49]; Siqueira A.F.P. et al., 2016 [41] |
| 647 | Sato H. et al., 1984 [40] |
| 655–660 | Corral-Baqués M.I. et al., 2005 [35], 2009 [36]; Fernandes G.H.C. et al., 2015 [48] |
| 780 | Lubart R. et al., 1997 [39] |
| 890–904 | Горюнов С.В., 1995 [53], 1996 [54]; Firestone R.S. et al., 2012 [55] |
Однако лазерный свет с такими параметрами невозможно или почти невозможно достаточно эффективно использовать в клинике в силу чисто биофизических особенностей (небольшая глубина оказываемого влияния). Частично проблема решается применением различного рода световодов для доставки световой энергии в нужное место через полости, например ректальное освечивание предстательной железы, но полноценное применение ЛТ возможно только при использовании импульсного НИЛИ красного и инфракрасного (ИК) спектра [31, 56]. Важно, что качественно общие закономерности, полученные из экспериментальных исследований, воспроизводятся и в клинике.
Лишь в одной работе использовали импульсный ИК-лазер (длина волны — 905 нм) мощностью 50 Вт (длительность импульса — 200 нс), плотность мощности — 50 Вт/см2 , причем даже при далеко неоптимальной (мягко говоря) частоте 10 000 Гц наблюдали повышение подвижности и отсутствие повреждений ДНК. Вероятно, положительный результат был получен вследствие небольшой экспозиции (30 с), причем он отсутствовал при нормои астеноспермии, а наблюдался, и весьма значительный (в 8,4 раза), только при олигоастенотератозооспермии через 30 мин после лазерного освечивания [55]. Это подтверждает известное мнение, что степень влияния НИЛИ коррелирует с выраженностью имеющихся нарушений [31]. Негативного влияния на ДНК не могло быть в принципе даже при таких явно завышенных энергетических параметрах.
Отсутствие повреждения ДНК сперматозоидов человека подтверждено также для непрерывного НИЛИ красного спектра (длина волны — 633 нм), даже несмотря на то, что при достаточно высокой плотности мощности (31 мВт/см2 ) освечивание проводили в течение 30 мин (!). Более того, подвижность сперматозоидов даже незначительно выросла.
С.В. Горюнов (1995, 1996) [53, 54] показал, что оптимальная экспозиция как для длины волны НИЛИ 633 нм (непрерывный режим), так и для 890 нм (импульсный режим), при которой в наибольшей степени возрастает подвижность сперматозоидов, их окислительная активность и клеточный метаболизм, составляет 5 мин, при этом импульсный режим несколько эффективнее даже с учетом того, что лазерный свет в данном ИК-спектральном диапазоне хуже поглощается, чем в красном.
В отношении выбора оптимальной длины волны мнения расходятся. Например, показано, что при освечивании in vitro подвижность сперматозоидов у мужчин с астенозооспермией повышается в среднем в 4–5 раз почти независимо от длины волны источника света (470, 625, 660 и 850 нм), а при изучении интенсивности дыхания сперматозоидов морских червей выявлена выраженная спектральная зависимость в диапазоне длин волн 35–650 нм (максимум эффективности в диапазоне 400–430 нм) (рис. 1). P. Gabel et al. (2009) убеждены, что на результат влияют все параметры воздействия: длина волны, мощность, экспозиция и когерентность [57].
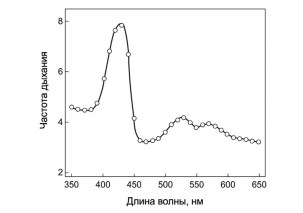
Рис. 1. Интенсивность дыхания сперматозоидов морских червей
Хотелось бы также обратить внимание на то, что все закономерности показаны при непосредственном воздействии на сперматозоиды in vitro, а при воздействии на организм пациента необходимо учитывать также и анатомические особенности тела человека. Исходя из известных обобщенных соображений, в частности понимания биофизики процессов поглощения и рассеяния лазерного света, для клинической практики чаще всего выбирают длину волны 635 нм (красный спектр) при воздействии на ткани и органы, расположенные на глубине до 5 см, и 890–904 нм (ИК-спектр) при более глубоком их залегании (до 15 см) [31, 51].
Выбор данных спектральных диапазонов определяется также тем, что именно в областях 600–650 и 850–900 нм наиболее выражено поглощение света сперматозоидами [48, 49].
Вывод
Экспериментальные исследования позволяют предположить перспективность применения лазерной терапии для лечения мужчин с различными формами бесплодия.
Литература
1. Божедомов В.А., Рохликов И.М., Третьяков А.А., и др. Андрологические аспекты бездетного брака // Медицинский совет. – 2013. – № 8. – С. 13–17. [Bozhedomov VA, Rokhlikov IM, Tretyakov AA, et al. Andrologic aspects of infertile marriage. Meditsinskiy sovet. 2013;(8):13-17. (In Russ.)]
2. Оль Д., Шустер Т., Кволич С. Мужское бесплодие // Репродуктивная медицина и хирургия / Под ред. Т. Фальконе, В. Херд. – М., 2013. – С. 616–631. [Ol’ D, Shuster T, Kvolich S. Muzhskoye besplodiye. Reproduktivnaya meditsina i khirurgiya. Ed by T. Fal’kone, V. Kherd. Moscow; 2013. P. 616-631. (In Russ.)]
3. Dohle GR, Diemer T, Giwercman A, et al. Мужское бесплодие. – Европейская ассоциация урологов, 2010. [Dohle GR, Diemer T, Giwercman A, et al. Male infertility. European Association of Urology; 2010. (In Russ.)]
4. WHO Manual for the Standardized Investigation, Diagnosis and Management of the Infertile Male. Cambridge: Cambridge University Press; 2000. P. 91.
5. Аляев Ю.Г., Григорян В.А., Чалый М.Е. Нарушения половой и репродуктивной функции у мужчин. – М.: Литтерра, 2006. [Alyayev YuG, Grigoryan VA, Chalyy ME. Narusheniya polovoy i reproduktivnoyfunktsii u muzhchin. Moscow: Litterra; 2006. (In Russ.)]
6. Божедомов В.А. Мужской фактор бездетного брака — пути решения проблемы // Урология. – 2016. – № S1. – С. 29–35. [Bozhedomov VA. The male factor in childless marriage — problemsolving strategies. Urologiia. 2016;(S1):29-35. (In Russ.)]
7. Чалый М.Е., Ахвледиани Н.Д., Харчилава Р.Р. Мужское бесплодие // Урология. – 2017. – № S2. – С. 4–19. [Chalyi ME, Akhvlediani ND, Kharchilava RR. Male infertility. Urologiia. 2017;(S2):4-19. (In Russ.)]
8. Щеплев П.А., Аполихин О.И. Мужское бесплодие. Обсуждение консенсуса // Вестник репродуктивного здоровья. – 2010. – № 3-4. – С. 37–44. [Shcheplev PA, Apolikhin OI. Muzhskoye besplodiye. Obsuzhdeniye konsensusa. Vestnik reproduktivnogo zdorov’ya. 2010;(3-4):37-44. (In Russ.)]
9. Nuti F, Krausz C. Gene polymorphisms/mutationsrelevant to abnormal spermatogenesis. Reprod Biomed. Online. 2008;16(4):504-13. doi: 10.1016/s1472-6483(10)60457-9.
10. Миктадова А.В., Машкина Е.В., Волосовцова Г.И., и др. Полиморфизм генов фолатного цикла и мужское бесплодие// Валеология. – 2014. – № 1. – С. 38–44. [Miktadova AV, Mashkina EV, Volosovtscova GI, et al. Polymorphism of folate cycle genes and male infertility. Valeologiya. 2014;(1):38-44. (In Russ.)]
11. Москвин С.В., Хадарцев А.А. Лазерный свет— можно ли им навредить? (обзор литературы) // Вестник новых медицинских технологий. – 2016. – Т. 23. – № 3. – С. 265–283. [Moskvin SV, Khadartsev AA. Laserlight— itcan harmthem?(literaturereview). Vestnik novykh meditsinskikh tekhnologiy. 2016;23(3):265-283. (In Russ.)]
12. Науменко В.А., Кущ А.А. Герпесвирусы и мужское бесплодие: есть ли связь? // Вопросы вирусологии. – 2013. – Т. 58. – № 3. – С. 4–9. [Naumenko VA, Kushch AA. Herpes viruses and male infertility — is there any relationship? Voprosy virusologii. 2013;58(3):4-9. (In Russ.)]
13. Науменко В.А., Тюленев Ю.А., Пушкарь Д.Ю., и др. Влияние вируса простого герпеса на сперматогенез // Урология. – 2011. – № 6. – С. 32–36. [Naumenko VA, Tyulenev YuA, Pushkar DYu, et al. Effect of Herpes Simplex virus on spermatogenesis. Urologiia. 2011;(6):32-36. (In Russ.)]
14. Schuppe HC, Pilatz A, Hossain H,etal. Urogenital infection asarisk factor for male infertility. Dtsch Arztebl Int. 2017;114(19):339-46. doi: 10.3238/arztebl.2017.0339.
15. Аль-Шукри С.Х., Кузьмин И.В., Слесаревская М.Н., Соколов А.В. Влияние низкоинтенсивного лазерного излучения на показатели эякулята у больных хроническим простатитом // Урологические ведомости. – 2015. – Т. 5. – № 4. – С. 8–12. [Al-Shukri SH, Kuzmin IV, Slesarevskaya MN, Sokolov AV. The effect of low-intensity laser radiation on semen parameters in patients with chronic prostatitis. Urologicheskiye vedomosti. 2015;5(4):8-12. (In Russ.)]
16. Балтер Р.Б., Михайлов Д.В., Иванова Т.В. Бесплодный брак. – Самара, 2015. [Balter RB, Mikhaylov DV, Ivanova TV. Besplodnyy brak. Samara; 2015. (In Russ.)]
17. Жиборев Б.Н. Варикоцеле и мужское бесплодие в аспекте полигенной природы гипогонадизма и проявлений синдрома дисплазии соединительной ткани // Российский медико-биологический вестник им. академика И.П. Павлова. – 2007. – № 4. – С. 72–79. [Zhiborev BN. Varicocele and male sterility in view of polygenic hypogonadism nature and the manifestation of dysplasia syndrome of the connective tissue. Rossiyskiy medikobiologicheskiy vestnik im. akademika I.P. Pavlova. 2007;(4):72-79. (In Russ.)]
18. Condorelli RA, Russo GI, Calogero AE, et al. Chronic prostatitis and its detrimental impact on sperm parameters: a systematic review and meta-analysis. J Endocrinol Invest. 2017;40(11):1209-18. doi: 10.1007/s40618-017-0684-0.
Статья опубликована в журнале "Урологические ведомости". Номер №4/2017 стр. 44-53













Комментарии